近日,我校生物系副教授汪涛课题组在Molecular Microbiology上发表研究论文揭示结核杆菌蛋白酶体调控复合体ATPase作用机理。
蛋白质特异性降解调控与细胞中很多生命活动密切相关,20S蛋白酶体是负责蛋白质特异性降解的重要复合体,它是由14个α亚基与14个β亚基组成的分子量达到750KDa的28聚体蛋白质分子机器,泛素(Ubiquitin,Ub)-20S蛋白酶体信号通路普遍存在于包括人在内的真核生物(Eukaryotes ),由于其极端重要的生物学功能,这一发现获得2004年Nobel化学奖。
在真核生物中,待降解的蛋白质底物通常被Ub泛素化并被蛋白酶体19S调控颗粒识别,进而通过去折叠和去泛素化等过程转运到20S蛋白酶体核心颗粒中降解成小肽片段。真核生物19S调节颗粒包含由六个不同的ATPase (Rpt1-6)组成的六聚体ATPase,它通过水解ATP为转运待降解的蛋白质底物进入蛋白酶体20S核心颗粒提供能量和识别通道。古细菌通过泛素类似样蛋白SAMPs共价结合待降解的蛋白质,然后被蛋白酶体相关同源ATPase六聚体(PAN)识别,最终被转运到20S蛋白酶体完成降解。
在原核生物中,2008年在Science上首次报道发现结核病的致病原-结核杆菌(Mycobacterium tuberculosis)具有类泛素(Prokaryotic Ubiquitin-like Protein,Pup)-20S蛋白酶体信号途径:与真核生物泛素Ub蛋白酶体通路相似,原核类泛素蛋白Pup通过iso-peptide共价结合待降解的蛋白质底物,六聚化蛋白酶体ATPase(Mycobacterium tuberculosis Proteasomal ATPase,Mpa)是Pup-20S蛋白酶体系统中的关键组成部分, Mpa蛋白六聚体具有对Pup共价结合蛋白进行识别、去折叠和转运的作用,作为调控复合体能够通过降解ATP识别并转运Pup共价结合的蛋白质底物进入20S蛋白酶体中进行降解。Pup-20S蛋白酶体系统在结核杆菌中具有维持其感染力和毒性的重要作用,相关基因的突变能够降低结核杆菌对小鼠的毒性和致死性,因此Pup-20S蛋白酶体系统是很好的抗结核病潜在药物靶标通路。
众所周知蛋白酶体调控颗粒ATPase六聚体具有巨大的结构柔性,其结构功能研究有着巨大的困难,因此一直没有蛋白酶体相关ATPase天然六聚体复合物的晶体结构报道。汪涛课题组通过8年多努力,成功克服蛋白质结晶以及结构解析等方面困难,获得了Mpa近全长天然六聚体晶体结构 (分子量>300KDa),这也是世界上第一个蛋白酶体相关ATPase天然六聚体的晶体结构报道。
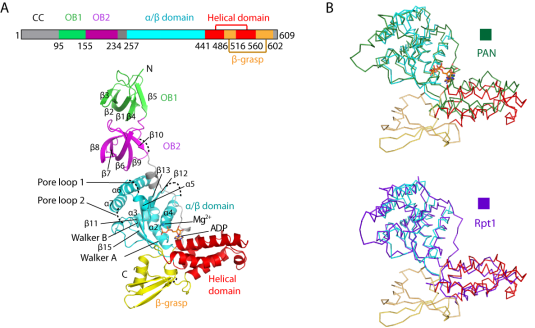
研究表明,Mpa六聚体除了与真核生物蛋白酶体调节颗粒Rpt1-Rpt6蛋白六聚体以及古细菌PAN蛋白六聚体具有一定的结构同源性之外,还具有一些明显不同的结构特征:(1)结核杆菌Mpa具有形成双环的两个串联寡核苷酸/寡糖结合(OB)结构域,而古细菌蛋白酶体相关ATPase调控颗粒(PAN)和真核生物蛋白酶体ATPase调控颗粒复合体(Rpt1-6)每个蛋白亚基都只具有单个OB结构域;(2)Mpa在具有蛋白酶体活化功能的C末端之前具有一个泛素样的β-grasp结构域,而古细菌PAN和真核生物Rpt1-6蛋白复合体并不具有这样的一个β-grasp结构域,Mpa的结构域如图1所示。
.png)
图1. 结核杆菌蛋白酶体相关ATPase结构域示意图
Mpa天然六聚体的晶体结构表明其结合了6个ADP分子,这与Harvard University本领域内著名的Alfred Goldberg教授在2011年针对原核生物蛋白酶体ATPase调控颗粒(PAN)所提出的模型不符,在他2011年的论文(Cell, 2011. 144(4): p. 526-538.)中,Alfred Goldberg教授针对原核生物PAN提出了一种可能的ATP结合和水解模式,推测PAN能同时结合2个ATP和2个ADP分子,其中ATP结合在六聚体PAN的对位,随着ATP降解为ADP,待降解的底物被不断的传递给20S蛋白酶体核心颗粒,但这种推测的机制与我们真实晶体结构所观察到的六个ADP结合情况相反,由于在我们之前从未有人获得真正的天然六聚化蛋白酶体ATPase结构信息,这一问题需要深入探讨(图2)。
.png)
.png)
.png)
图2. PAN的ATP降解模式与Mpa蛋白六聚体ADP结合的示意图
由于β-grasp结构域的存在,Mpa六聚体中各个蛋白亚基C末端被埋在结构核心中而没有暴露在蛋白复合体结构的表面,这就影响了C末端的GQYL基序与20S 蛋白酶体复合体的对接,从而阻碍了六聚化的Mpa与七次对称的28聚体的蛋白酶体相互作用。我们通过功能研究进一步解释了为什么单独的Mpa六聚体在体外情况下不能有效结合蛋白酶体核心颗粒并启动蛋白质特异性降解,结合晶体结构域功能研究,我们提出了结核杆菌蛋白酶体ATPase调控颗粒Mpa与20S蛋白酶体复合体这一分子量超过1100KDa蛋白质机器的作用模型(图3)。
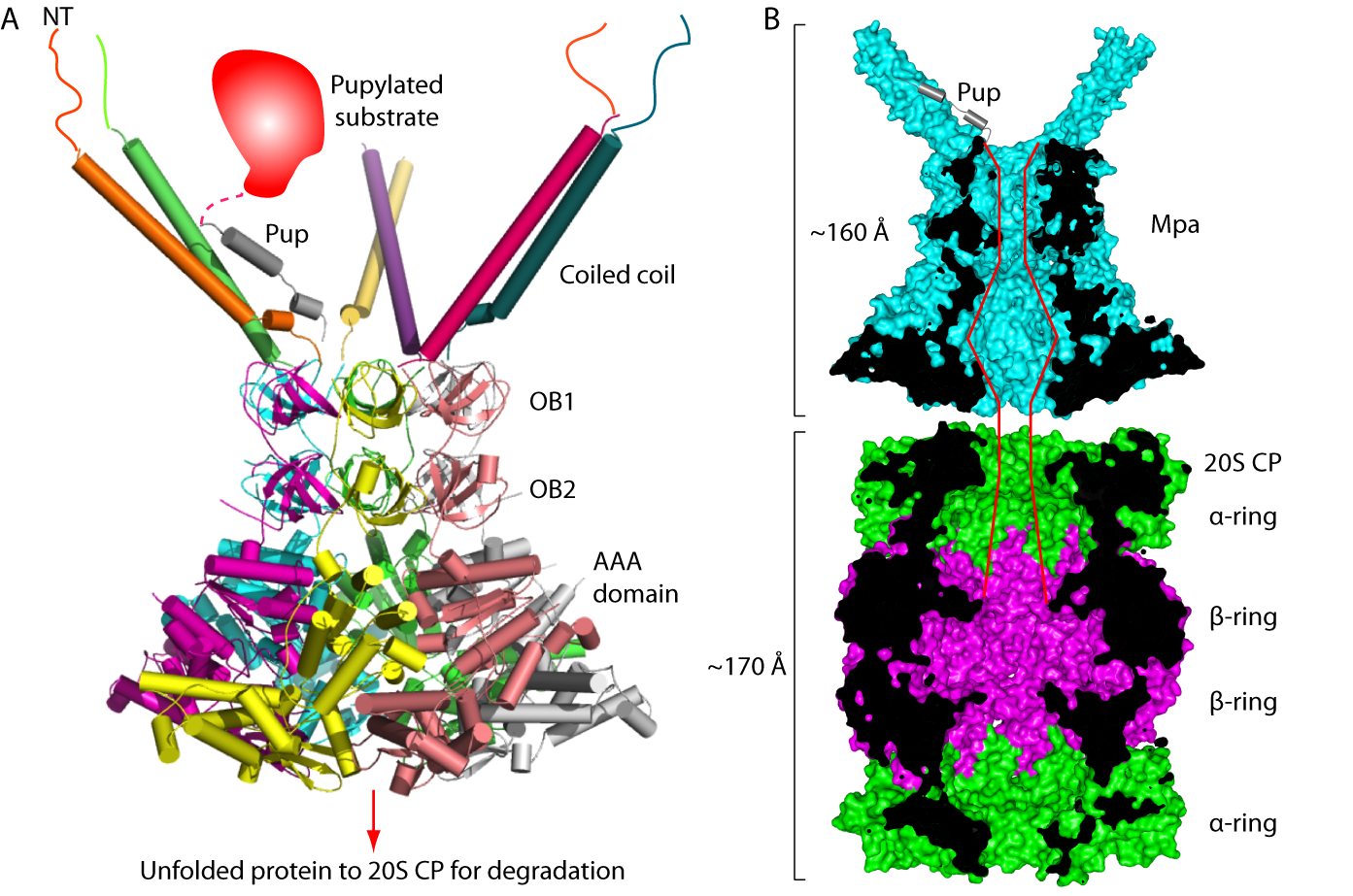 图3. 结核杆菌类泛素蛋白降解途径ATPase调控颗粒的作用模型
图3. 结核杆菌类泛素蛋白降解途径ATPase调控颗粒的作用模型
本工作以南方科技大学为第一单位,我校生物系博士后吴宇杰、美国Van Andel研究所Kuan HU为论文共同第一作者,我校生物系2013级本科生肖书豪是论文的共同作者。汪涛与美国Van Andel研究所Huilin LI教授为论文的共同通讯作者。论文以“Mycobacterium tuberculosisproteasomal ATPase Mpa has a β-grasp domain that hinders docking with the proteasome core protease”为题发表在国际著名微生物学期刊Molecular Microbiology上。这也是继2009年(Structure 17: 1377–1385);2010年(Nat Struct Mol Biol 17: 1352–1357.)针对结核杆菌类泛素蛋白降解系统蛋白酶体ATPase调控颗粒的进一步研究成果。
本研究工作得到了美国NIH基金、Burroughs Wellcome 基金、中国国家自然科学基金、科技部国家重大研究计划与深圳市基础研究学科布局等研究基金的支持。
文章链接: http://onlinelibrary.wiley.com/doi/10.1111/mmi.13695/full
供稿:生物系




