调控蛋白-蛋白相互作用(PPIs)是疾病治疗靶点的重要方向,而通过化学手段将多肽稳定在某一固定构象的稳定多肽是重要的调节PPI的代表性化合物。尽管在过去的十余年中以哈佛大学Verdine教授,纽约大学Arora教授为代表的科学家们对稳定多肽进行了很深入的研究;但稳定多肽的二级构象对其生物物理性能的影响一直没有得到清楚的解释,最关键的问题在于无法获得化学构成相同而构象不同的多肽对比物和缺乏相应的多肽结构。
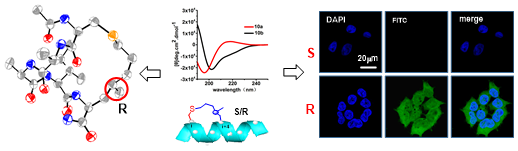
北京大学李子刚教授开创了新颖的“手性诱导螺旋”(CIH)稳定多肽二级结构的概念。通过多年研究,在稳定多肽的侧环上引入一个精准的手性中心,该手性中心的绝对构型为R型时可以决定性的调控多肽的二级结构。通过对CIH多肽两条具有完全一致氨基酸序列而二级构象又显著不同的多肽非对映异构体的研究,发现增加多肽的螺旋度可以显著增强多肽的稳定性; 进一步的研究表明表明了对于氨基酸序列一致的订书机多肽,提高多肽螺旋度可以显著增加多肽的穿膜能力和与靶点蛋白结合能力。同时还发现发现新引入的手性中心取代基团和蛋白结合口袋周围的区域会产生相互作用,为基于“片段法”的多肽药物设计提供了思路。
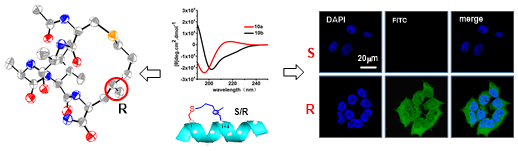
长期以来订书机螺旋多肽由于其特殊的柔性,国际上众多研究组一直未能得到其独立晶体结构,我校汪涛教授创造性的通过有机小分子成晶原理获得多肽结晶并利用生物大分子X射线晶体学方法收集了低温衍射数据,采用直接法解析了稳定多肽晶体结构,利用Flack方法确定了手性中心的绝对构型,晶体分辨率为0.82埃。北京大学吴云东院士对此体系进行了详细的分子动力学模拟,为手性诱导螺旋稳定多肽概念提供了坚实的理论支持。本研究成果发表在著名期刊《德国应用化学》(Angewandte Chemie)(2016,DOI: 10.1002/anie.201602806R1 )。论文第一作者为北京大学李子刚教授指导的博士生胡宽,李子刚教授、吴云东院士和汪涛教授为本文的共同通讯作者。
该工作得到了国家科技部,国家自然科学基金,深圳市科技创新委员会以及深圳市孔雀计划项目的支持。
论文链接为:http://onlinelibrary.wiley.com/doi/10.1002/anie.201602806/full。 (2016,DOI: 10.1002/anie.201602806R1 )
供稿:汪涛课题组




