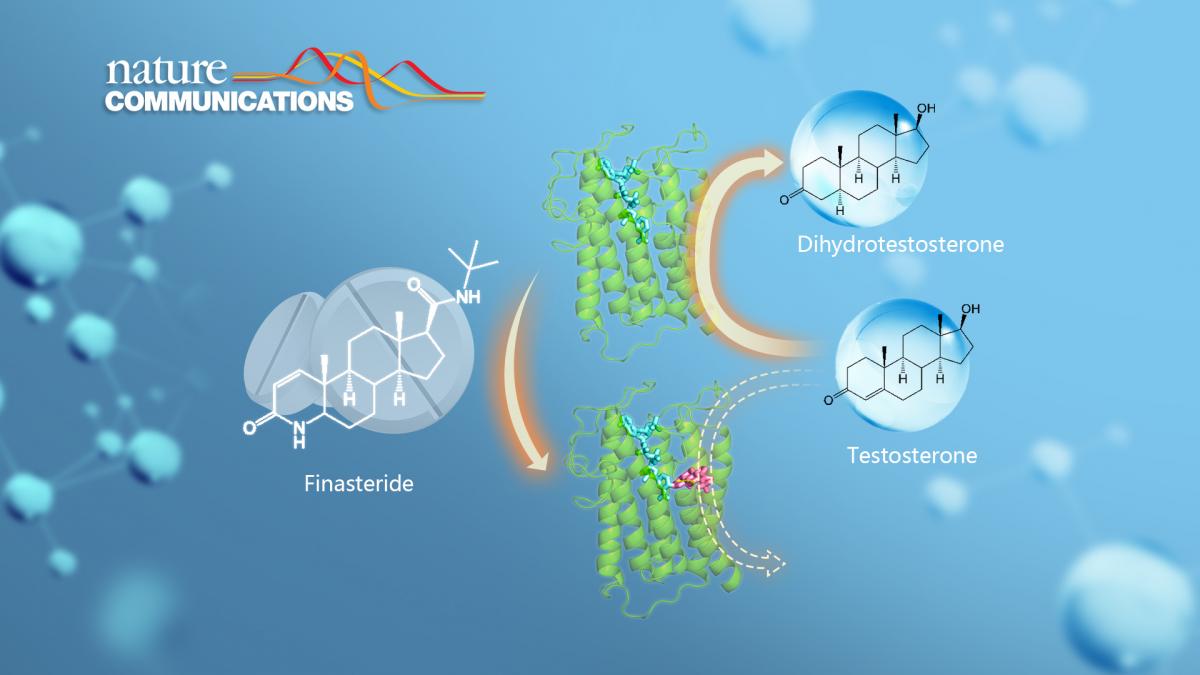
近日,南方科技大学生物系副教授魏志毅课题组与匹兹堡大学助理教授张诚、新加坡A*STAR研究所研究员范昊、腾讯AI lab研究小组,以“Structural of human steroid 5α-reductase 2 with the anti-androgen drug finasteride” 为题在《自然通讯》(Nature Communications)发表论文,首次报道真核生物中生物膜嵌合型类固醇还原酶的三维结构,提出治疗脱发和前列腺增生的药物分子非那雄胺对于该酶的抑制机制。
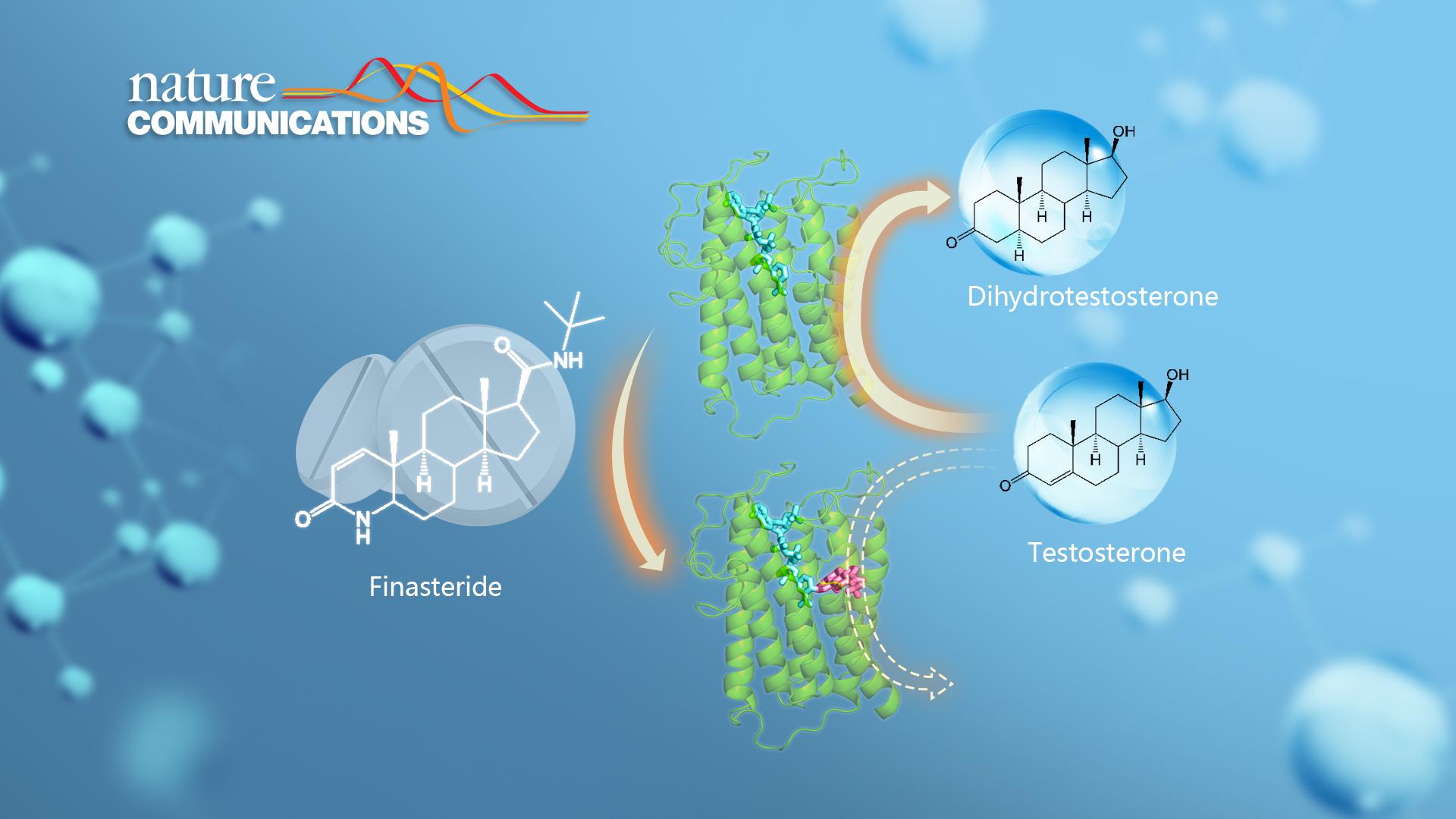
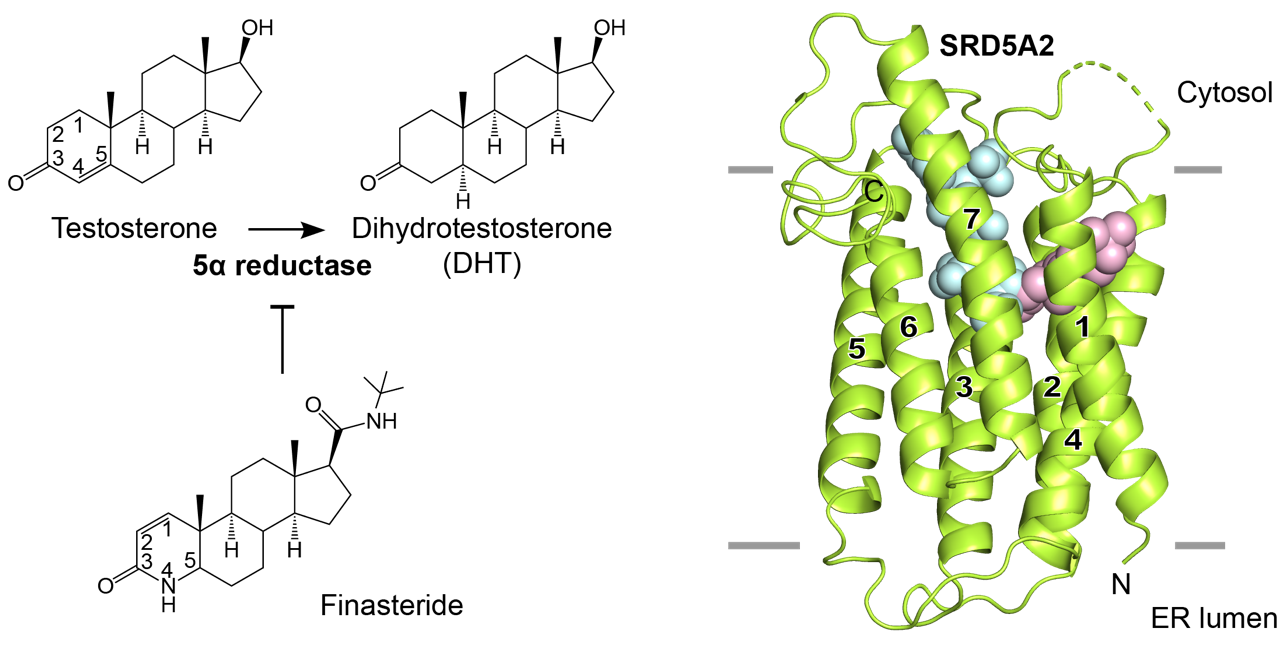
图1. SRD5A2(绿色)与辅酶(青色)和抑制剂非那雄胺(粉色)形成的复合物结构
人体内性激素的合成依赖于类固醇还原酶。其中一类生物膜嵌合型类固醇还原酶steroid 5α-reductase 2(SRD5A2)通过催化睾酮的还原反应来合成二氢睾酮。二氢睾酮是人体已知最强的雄激素,对人体的发育和生理活动至关重要。一方面,二氢睾酮控制男性性器官的发育,大量的临床数据发现SRD5A2酶分子上的氨基酸位点突变能够引发二氢睾酮水平低下,并造成男性性征缺陷。另一方面,过高水平的二氢睾酮又是导致前列腺增生和脱发的罪魁祸首。作为类固醇还原酶SRD5A2的高效抑制剂,非那雄胺(finasteride)被广泛用于治疗前列腺增生和雄激素源性脱发。尽管SRD5A2具有重要生理作用,然而由于缺乏高分辨率结构信息,SRD5A2催化二氢睾酮合成的机理以及非那雄胺抑制SRD5A2酶活性的机制并不清楚。
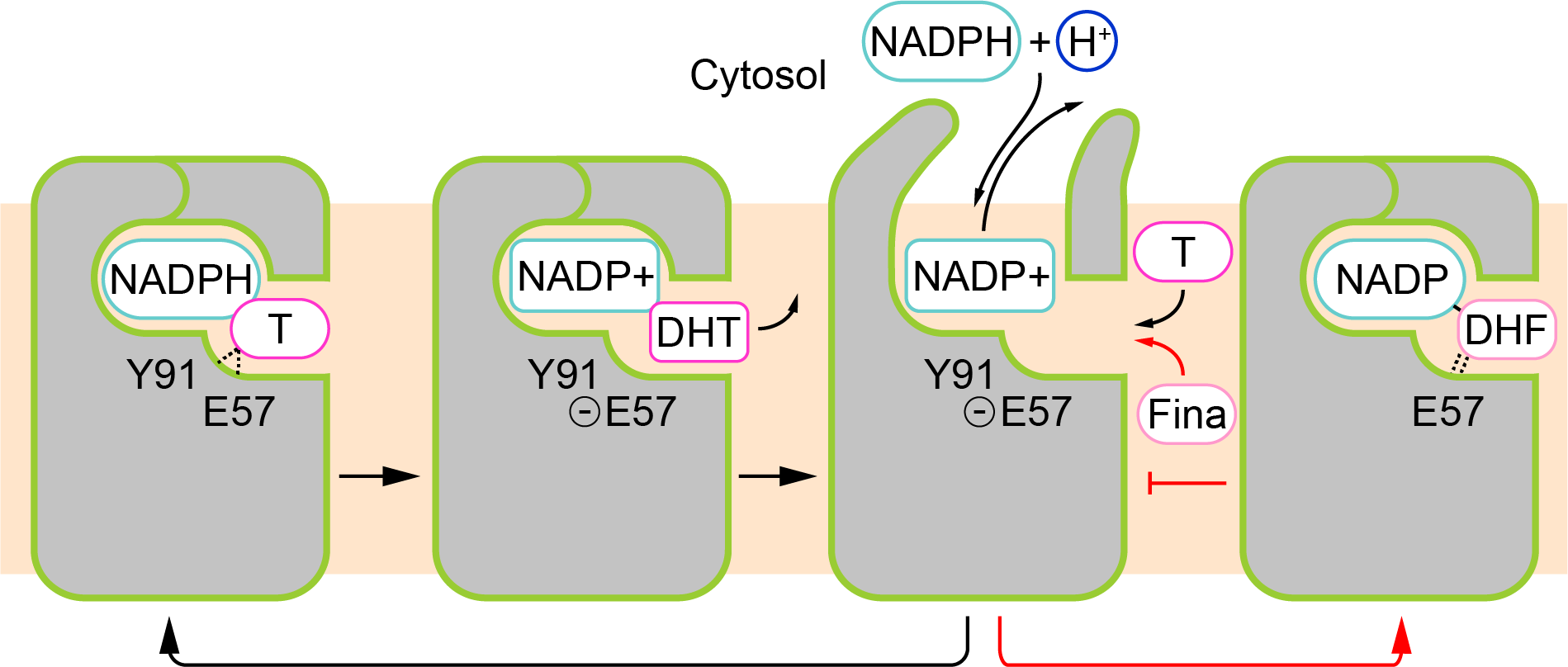
图2. SRD5A2酶催化机制与非那雄胺抑制机制的模型
利用结构生物学方法,研究团队成功解析了SRD5A2酶分子与非那雄胺所形成的复合物的高分辨率晶体结构。结构分析显示SRD5A2形成独特的七次跨膜结构,非那雄胺分子占据了底物睾酮分子的结合口袋。进一步分析发现,非那雄胺与辅酶因子NADPH以共价键结合形成稳定的中间体,破坏了酶催化过程中辅酶因子的变换,从而达到对SRD5A2酶活性的长效抑制作用。结合结构生物学、生物化学以及分子动力学模拟技术,研究团队提出了类固醇还原酶SRD5A2催化低物睾酮的酶催化机制模型,解释了致病的氨基酸突变对于酶结构及催化活性的影响。该研究推动了对于体内SRD5A2活性失调引发的各类疾病的理解,为基于结构的新药品开发提供更多有价值的参考信息。
南科大为论文的第一通讯单位,魏志毅、张诚、范昊为论文通讯作者,魏志毅课题组南科大-澳门大学联培博士生肖庆品为论文第一作者。本项研究得到了国家自然科学基金、深港脑科学创新研究院和南方科技大学分析测试中心的大力支持。
供稿:生物系
通讯员:付文卿
编辑:吴一敏
主图设计:丘妍




