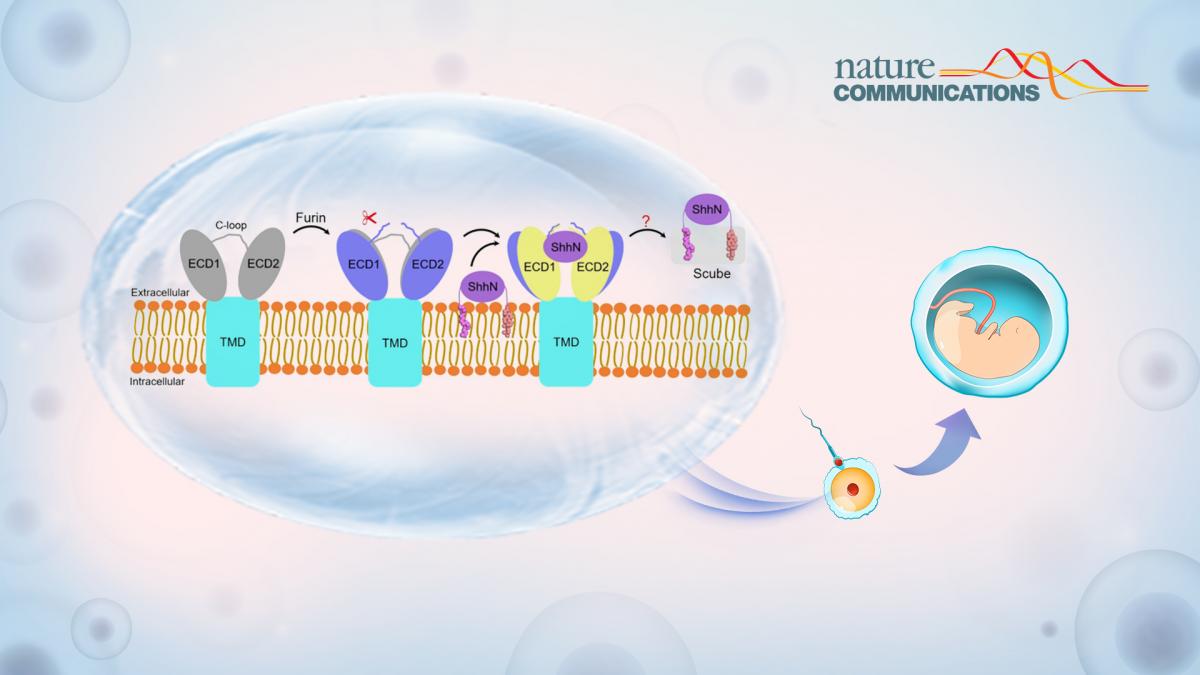
近日,南方科技大学生命科学学院副教授龚欣课题组和哈佛大学教授Adrian Salic课题组合作,在Nature Communications在线发表了题为“Structural insights into proteolytic activation of the human Dispatched1 transporter for Hedgehog morphogen release”的研究论文,针对Hedgehog(Hh)信号通路配体释放过程中的Dispatched1蛋白展开了深入研究,揭示了Hh信号通路中配体释放的关键分子机制。
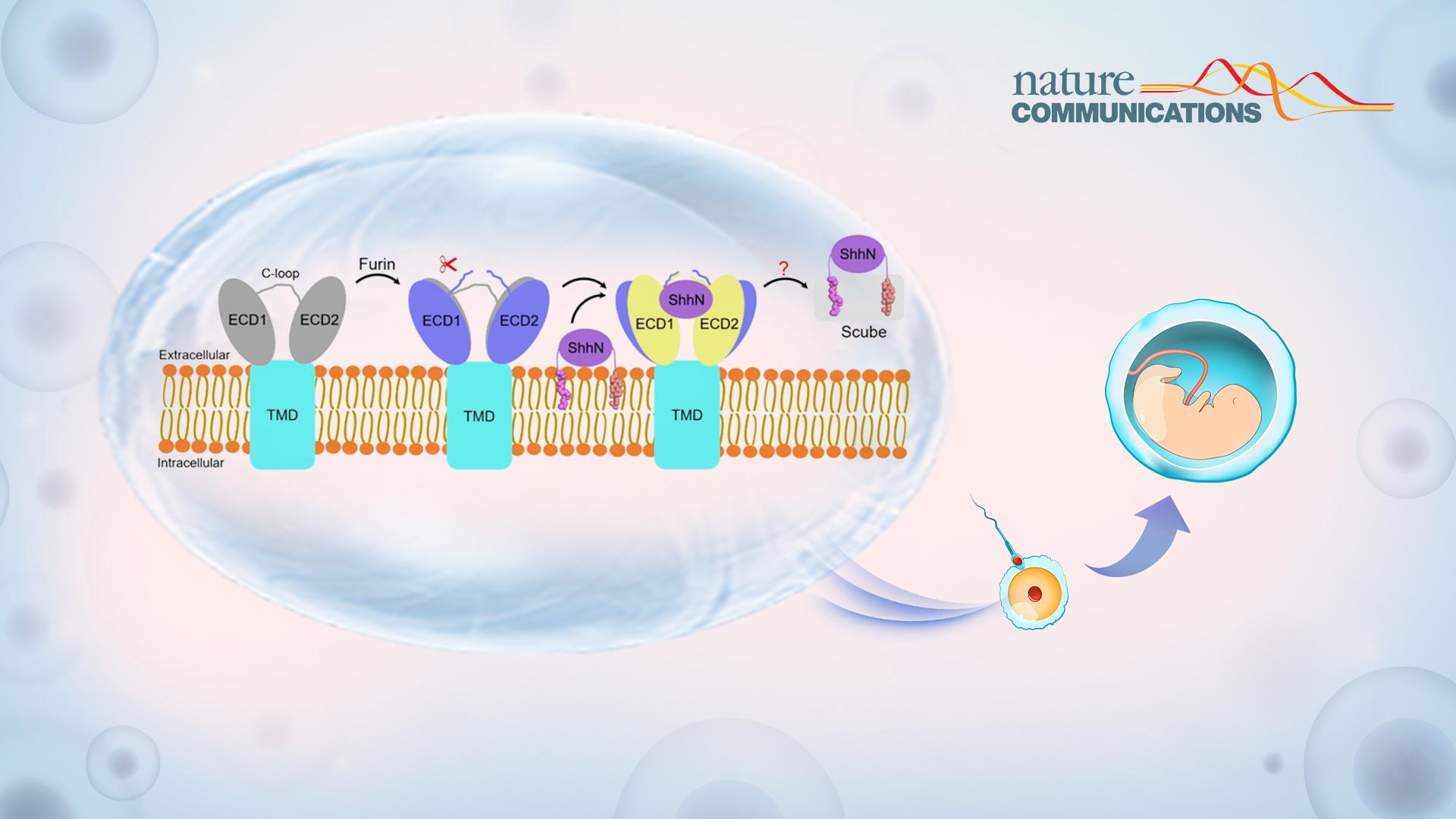
Hh信号通路是一条非常经典的细胞信号转导通路,参与调控胚胎发育和组织稳态,其失调会引起许多相关癌症以及先天性发育畸形。Hh配体是一种独特的具有双重脂修饰的蛋白质,包括N端的棕榈酰修饰和C端的胆固醇修饰。这种双重脂质修饰使得Hh配体具有极强的疏水性,并使其牢固地附着在产生Hh配体的细胞的质膜上。然而,在发育过程中,Hh配体需要被释放并扩散到细胞外,向靶细胞传递。因此需要有一个专门用于Hh配体释放以及运输的系统,这个系统主要包括细胞膜表面的多次跨膜蛋白Dispatched(Disp)和细胞外分泌的可溶蛋白Scube家族成员。
在Hh配体释放过程中,Disp和Scube通过协同作用,将具有双重脂修饰的Hh配体从质膜转移到Scube蛋白,确保Hh配体的脂修饰不受水环境的影响。随后,分泌的Scube-Hh复合物扩散到细胞外,并将Hh传递到靶细胞表面,在靶细胞表面Hh配体会与受体蛋白Patched 结合,从而启动信号转导。Disp蛋白在发挥正常功能前,需要在其第一个胞外区结构域(ECD1)进行Furin蛋白酶介导的切割,这一蛋白裂解事件导致Disp激活的机制,目前尚不清楚。
本研究中,研究人员首先开发了一种获得人源Disp1蛋白裂解前(未切割)和裂解后(完全切割)状态的策略:将Disp1中被Furin识别的区域替换为具有高度特异性的3C蛋白酶的裂解位点(图1,a-d),并利用生化研究表明蛋白裂解对Disp1的活性非常重要,并会影响其与Hh配体的结合。随后研究人员利用单颗粒冷冻电镜技术,成功解析了Disp1蛋白裂解前和裂解后分辨率分别为3.61 Å和3.68 Å的冷冻电镜结构(图1e,左,中)。同时,还解析了Disp1与脂修饰Hh配体复合物分辨率为4.07 Å的冷冻电镜结构(图1e,右)。解析的结构表明,蛋白裂解导致Disp1的胞外区结构域(ECD1和ECD2)之间更为张开,并且移除了由Furin酶切位点构成的空间位阻,使得Disp1与Hh配体的结合能力大大增加,从分子层面阐明了蛋白裂解激活Disp的机制(图2)。
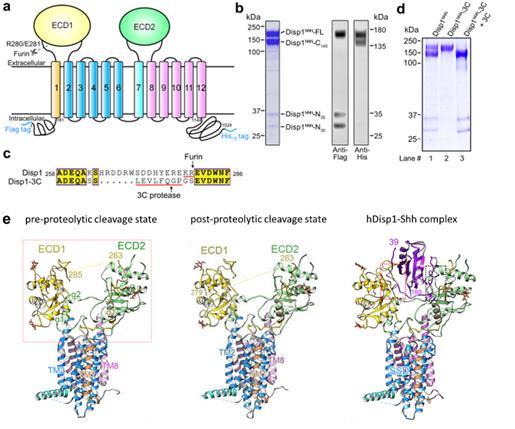
图1:人源Disp1蛋白处于三种不同状态的三维结构
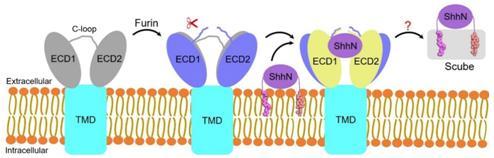
图2:Furin蛋白酶介导的Disp1裂解激活以及Hh配体释放的模型
龚欣与Adrian Salic为该论文的共同通讯作者。龚欣课题组原高级研究学者李婉秋(现南方科技大学医学院助理教授)、博士研究生王琳琳、哈佛大学博士后Bradley M. Wierbowski为本论文的共同第一作者。南科大为论文第一单位。该研究得到了国家自然科学基金、广东省杰出青年基金、深圳市优秀青年基金等项目的资助。该研究中电镜数据的收集和处理,均在南科大冷冻电镜中心完成,得到了中心的大力支持。
论文链接:https://www.nature.com/articles/s41467-021-27257-w
供稿:生命科学学院
文字:龚欣课题组
通讯员:付文卿
主图:丘妍
编辑:朱增光




