近日,南方科技大学生命科学学院助理教授陈曦课题组、副教授靳文菲课题组合作在Nature Methods杂志上发表标题为“灵敏且灵活的ISSAAC-seq在单细胞水平同时检测染色开放及基因表达”(ISSAAC-seq enables sensitive and flexible multimodal profiling of chromatin accessibility and gene expression in single cells)的论文。论文详细介绍了他们开发的一种新型的、简单可靠的单细胞多模态组学技术ISSAAC-seq,能够在同一细胞内,同时检测染色质可及性(ATAC-seq)以及基因表达(RNA-seq)。该方法操作灵活,既适用于基于孔板的低通量实验方案,又可以通过微流控装置进行高通量研究。
 在同一个细胞中,同时检测多种组学信息的技术即单细胞多模态组学技术(single cell multimodal omics)。该技术使得我们能够更好的发现细胞异质性和理解细胞精细状态,是当前基因组学研究的前沿领域[1]。单细胞多模态组学数据结合拟时间轨迹推演能够细致刻画复杂组织中的细胞亚型,刻画发育和分化过程中不同层次组学数据间的变化差异和动态,从而获得基因调控的关键信息。目前,已有多种技术能够在同一细胞中同时检测染色质开放性和基因表达,如SNARE-seq[2],sci-CAR-seq[3], Paired-seq[4],SHARE-seq[5]。但是这些技术因步骤多、过程复杂或数据质量不高等原因没有被广泛使用。因此,我们仍然需要一个更简洁、更灵敏、能够广泛应用的单细胞多组学技术。
在同一个细胞中,同时检测多种组学信息的技术即单细胞多模态组学技术(single cell multimodal omics)。该技术使得我们能够更好的发现细胞异质性和理解细胞精细状态,是当前基因组学研究的前沿领域[1]。单细胞多模态组学数据结合拟时间轨迹推演能够细致刻画复杂组织中的细胞亚型,刻画发育和分化过程中不同层次组学数据间的变化差异和动态,从而获得基因调控的关键信息。目前,已有多种技术能够在同一细胞中同时检测染色质开放性和基因表达,如SNARE-seq[2],sci-CAR-seq[3], Paired-seq[4],SHARE-seq[5]。但是这些技术因步骤多、过程复杂或数据质量不高等原因没有被广泛使用。因此,我们仍然需要一个更简洁、更灵敏、能够广泛应用的单细胞多组学技术。
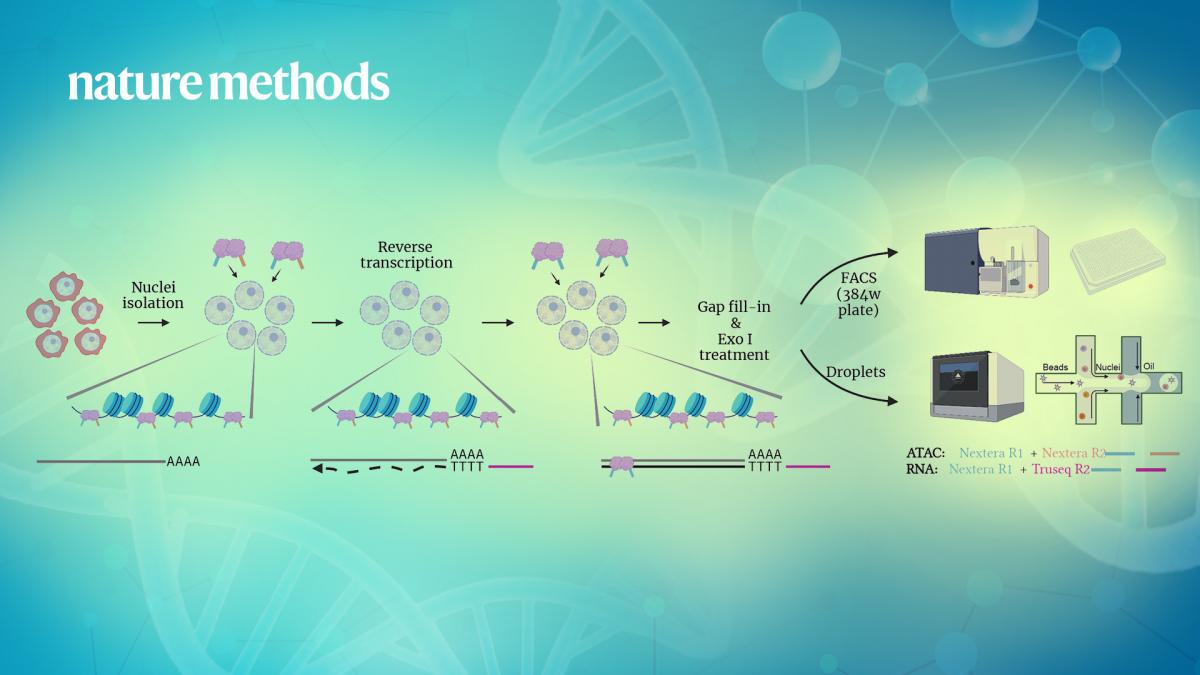
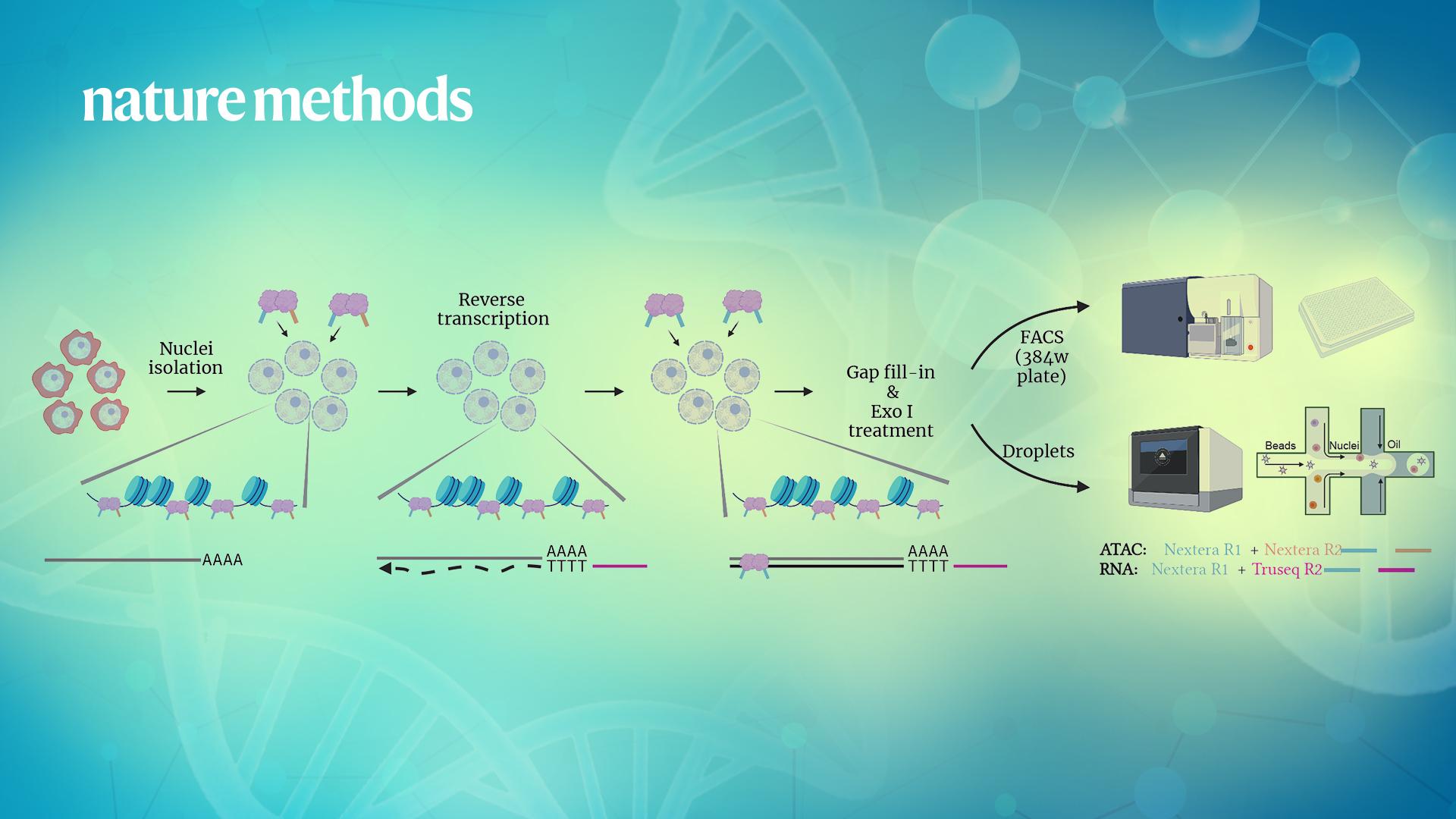
ISSAAC-seq技术全称为in situ SHERRY after ATAC-seq,顾名思义,其原理基于最近开发的Sequencing HEteRo RNA-DNA-hYbrid (SHERRY) RNA-seq方法[6,7]和陈曦课题组此前发表的scATAC-seq方法[8,9]。实验设计在细胞原位通过两轮差异化的Tn5转座反应,分别标记ATAC-seq和RNA-seq序列,混合扩增建库后测序。实验基本流程为:分离细胞核->开放染色质标记->原位逆转录->原位标记DNA/RNA杂合链->酶切缺口补齐及单链DNA消化->单细胞分选->文库扩增。由于在RNA原位逆转录时使用了含有TruSeq adapter序列的特异逆转录引物,使得以TruSeqadapter序列为index,可将RNA-seq数据与ATAC-seq数据分离,进行后续数据分析。ISSAAC-seq 的关键步骤之一是在 30 °C 下对染色质开放区域进行标记,而不是 ATAC-seq 实验中常用的 37 °C。30°C 的染色质标记不会影响 ATAC-seq 文库的数据质量,并显著提高了RNA-seq文库的检测质量。
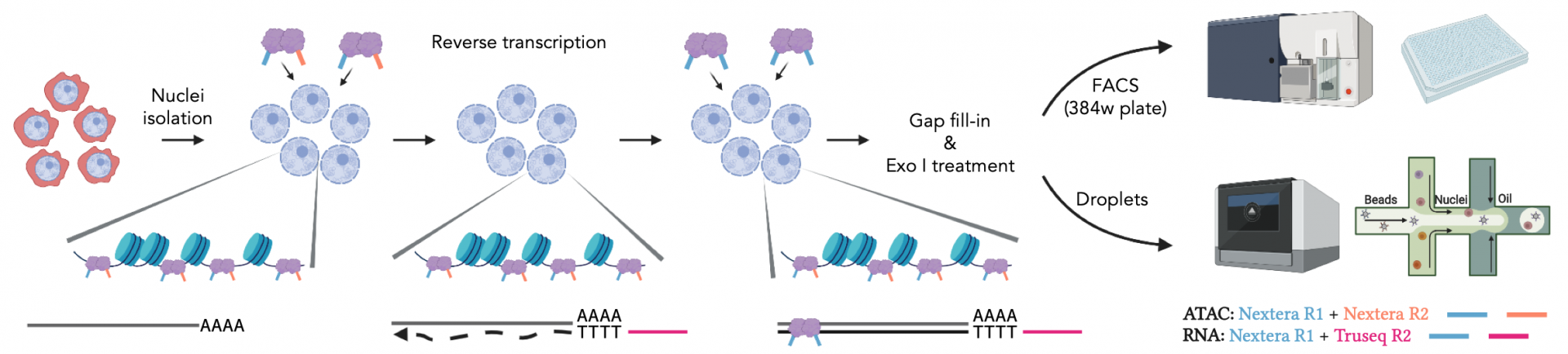
图1.最新开发的ISSAAC-seq实验的基本设计以及核心步骤
这一设计避免了同类方法中的多次细胞混合和分离过程,无需index片段连接,简化了实验流程,提高了建库效率,并得到更高的数据质量。该方法另一大优点是其模块化的设计使得操作十分灵活,分为原位反应模块以及单细胞分选模块。在原位反应模块中,所有的化学反应均在群体水平的细胞核内完成。随后,研究人员可根据自身课题需要、现有仪器设备等因素,自行决定单细胞分选的方法。既可以通过孔板进行小量的测试或者对稀有样品的解析,也可以采用微流控装置进行大量的单细胞测序。对于微流控装置,凡是带有Nextera TruSeq Read 1序列的平台,均可使用。例如10x Genomics Single Cell ATAC[10],Bio-Rad dscATAC-seq[11]以及HyDrop-ATAC[12]。在文章中,作者测试了基于10x Genomics Single Cell ATAC平台或基于多孔板流式分选平台,结果显示ISSAAC-seq均能在单细胞中测得大于10,000 ATAC uniquereads in peaks和2000-5000个基因表达。其数据质量与10x Genomics Multiome试剂盒相近,远高于已发表的其他开源方法,但成本仅为10x Genomics Multiome试剂盒的一半或更低。
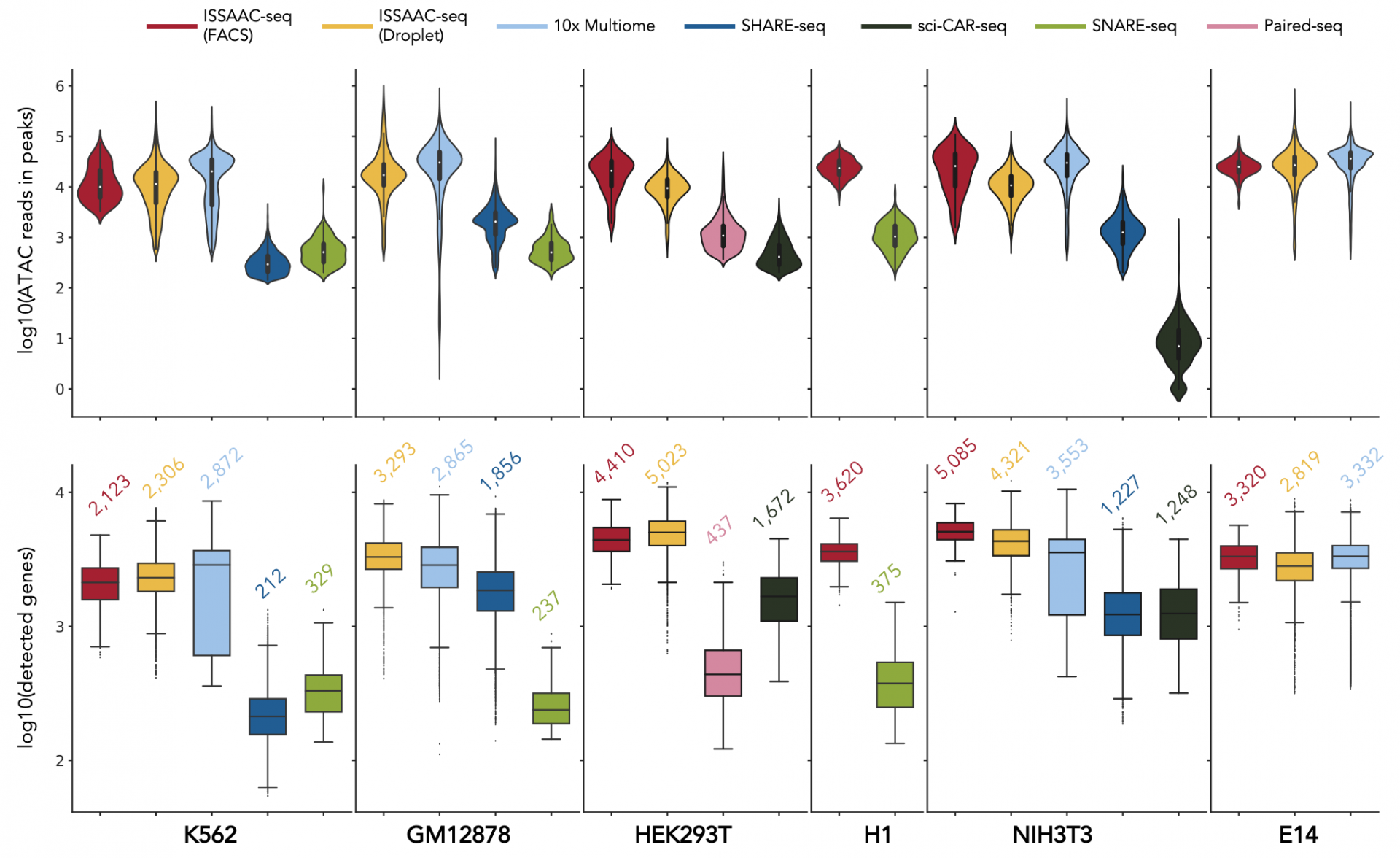
图2.ISSAAC-seq与同类单细胞多模态组学技术在不同细胞系中产生的数据质量比较
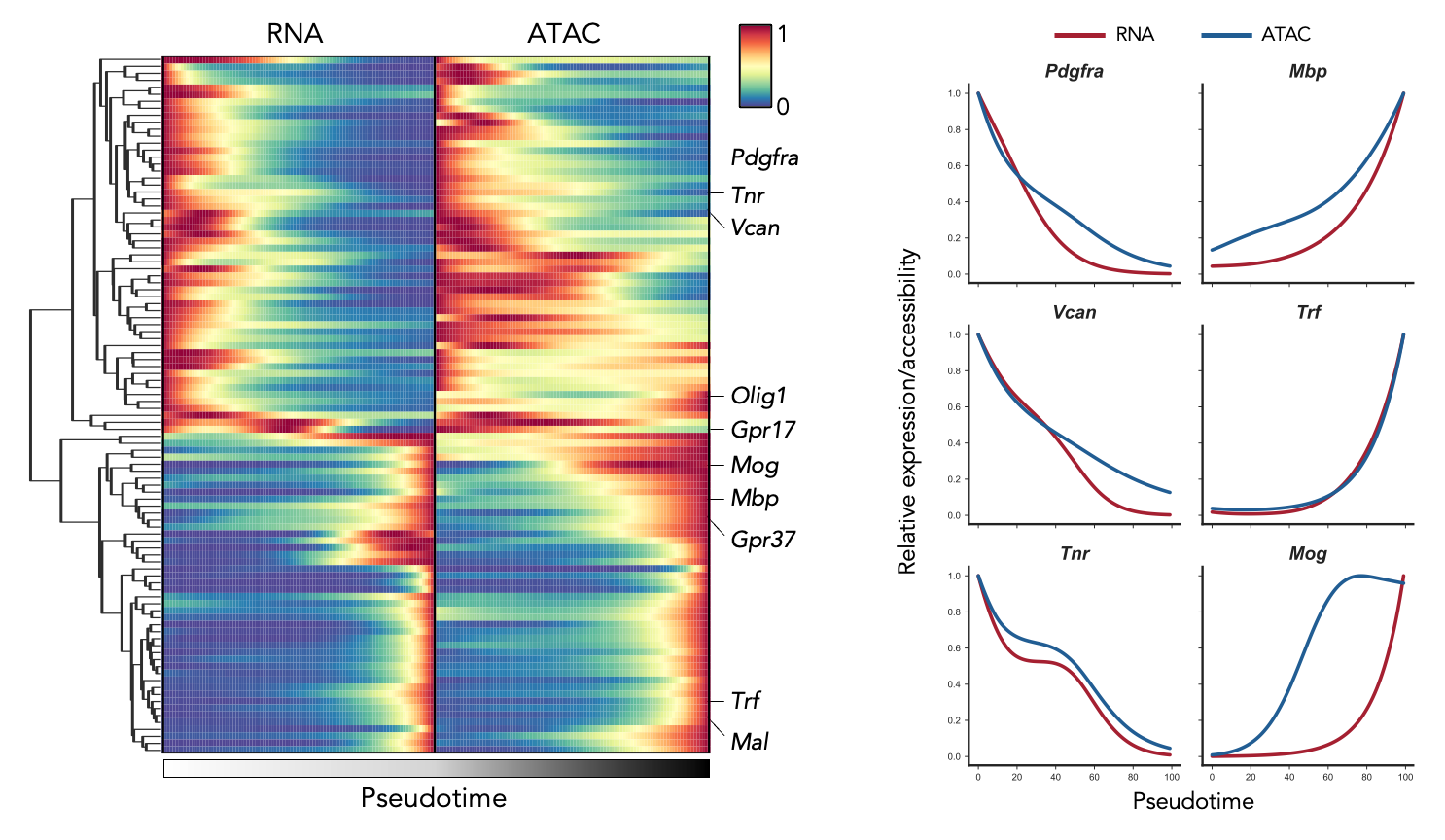
图3.ISSAAC-seq解析oligodendrocyte成熟过程中的染色质可及性和基因表达的动态关系
利用这一技术,研究人员分析了来自小鼠大脑皮层的10,000多个细胞,鉴定发现了小鼠大脑皮层中主要的和罕见的细胞类型以及细胞类型特异性调控元件,并在由转录组测序结果定义的细胞类群中,进一步分析了染色质开放水平的异质性,揭示了在少突胶质细胞成熟轨迹期间基因表达和染色质可及性的不同动态关系。
ISSAAC-seq的高度可重复性、模块化设计和低成本的小规模预实验模式也为这一技术在方法学上的进一步拓展提供了可能。
南科大生命科学学院研究助理教授徐玮、高级研究学者杨伟龙为论文的共同第一作者,陈曦、靳文菲为论文的共同通讯作者。此方法也得到了生命科学学院副教授宋昆和研究助理教授洪旎的帮助,博士后陈雅文、博士研究生张云龙等人也参与了该项工作。南科大为论文的唯一单位,全部作者均来自南科大生命科学学院深圳市基因调控与系统生物学重点实验室。该研究得到了科技部重点研发计划、国家自然科学基金委员会、广东省基础与应用基础研究基金委员会、深圳市科学创新委员会、深圳市孔雀团队、深港脑科学研究院项目的资助。
论文链接:https://www.nature.com/articles/s41592-022-01601-4
供稿:生命科学学院
通讯员:付文卿
主图:丘妍
编辑:朱增光




