近日,南方科技大学医学院傅暘课题组与华中农业大学李姗课题组合作在Molecular Cell发表题为“Structural insights into caspase ADPR-deacylization catalyzed by a bacterial effector and host calmodulin”的论文并获选当期封面文章。研究人员利用单颗粒冷冻电镜技术成功捕捉到CaM-CopC-caspase-3三元复合物与配体NAD+在反应前、反应中和反应后三种状态下的高分辨率结构,揭示了病原菌通过ADPR-deacylization修饰caspase调控程序性细胞死亡的分子基础,为开发相关细菌感染性疾病药物提供了新靶点和理论基础。
利用Ⅲ型分泌系统(Type III Secretion System,T3SS)向宿主“注射”效应蛋白,模拟或操纵宿主的信号转导通路,促进侵染和定殖,是许多革兰氏阴性病原细菌的核心感染策略。近期,北京生命科学研究所邵峰院士/北京大学基础医学院刘小云教授联合团队,与华中农业大学李姗教授课题组分别在研究中发现T3SS效应蛋白OspC3和CopC能够催化全新骨架的蛋白质翻译后修饰,暨精氨酸-ADP核糖脱氨环化修饰,作用于宿主细胞caspase蛋白家族,抑制caspase的半胱氨酸蛋白酶活性,从而调控凋亡、坏死和焦亡等多种程序性细胞死亡。这一新颖的蛋白质翻译后修饰,需要在人类宿主特异存在的钙调蛋白(Calmodulin,CaM)帮助下完成,保证了病原细菌毒力蛋白只在进入宿主后才发挥功能。
CopC由N端的催化结构域(N-terminal catalytic domain, NCD)以及C端的锚蛋白重复结构域(ankyrin repeats domain,ANK)构成。通过同源结构比对,研究人员发现CopC的整体结构与数据库现有蛋白结构相似度不高,但其 NCD所包含的6个β折叠片层和ADP-核糖转移酶(ADP-ribosyltransferase,ART)的核心催化域类似,然而与经典的含有”H-Y-E”或者”R-S-E”基序的ART不同的是,CopC通过其特有的”H-F-F-D”基序来结合和催化NAD+的水解。CopC的整体结构形似一只手:NCD的N端向外延伸的螺旋结构代表大拇指;NCD的其余部分代表手掌;ANK结构域的四对螺旋结构代表4个手指。CopC通过ANK形成的手指抓住底物caspase-3,同时caspase-3的活性区域(包含修饰位点R207所在loop区)贴在NCD形成的手掌上。辅助因子CaM则像一个扳指套在CopC的大拇指上(图1),调节催化反应活性。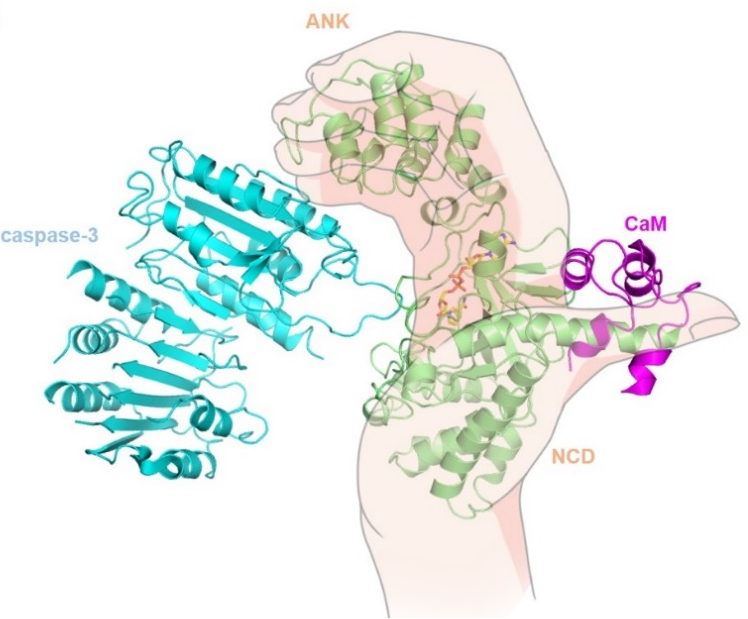
图1. CaM-CopC-caspase-3三元复合物结构
Caspase-3中修饰位点R207所在的loop结合在NCD表面的一片疏水区域,R207的侧链则穿过NCD表面,延伸至NAD+的烟酰胺核糖(N-ribose)附近。与此同时,CopC上一个高度保守的天冬氨酸D172与R207形成氢键相互作用,将R207的侧链稳定在N-ribose附近。在已知的精氨酸ADP-核糖化过程中,一般是由精氨酸上的NH2对 NAD+中的烟酰胺进行亲核取代,连接至N-ribose的C1原子上。然而caspase-3 R207上的NE(Nδ)原子比NH2(Nω)更接近N-ribose的C1原子。NAD+的水解进一步缩短了N-ribose C1与R207 NE的距离,促进亲核取代反应的发生,使ADP-核糖基团转移至R207的NE原子上。随后N-ribose的2’-OH被活化,进攻精氨酸侧链胍基的碳原子,引发脱氨和环化反应,从而完成精氨酸的ADPR-deacylization修饰。
此项研究还捕捉到了反应完成后caspase-3将要从CopC上分离的状态。通过对不同状态下结构的比较分析,研究人员发现CopC NCD上存在两个非常特殊的loop, 这两个loop同时参与了CopC NCD与NAD+以及ANK的结合。随着酶学催化反应的进程(NAD+水解和ADP-核糖脱氨环化反应),这两个loop的构象发生变化,引起NCD与ANK相互作用面的改变, 进而导致与ANK结合的caspase-3发生转动并远离NCD,最终造成caspase-3从CopC上分离。
真核宿主中特异存在的钙调蛋白CaM是如何帮助CopC发挥功能的呢?研究人员比较CopC-caspase-3二元复合物和CaM-CopC-caspase-3三元复合物的结构发现,在有CaM存在时,CopC的NCD催化结构域才可正确折叠、有序组装。体外生化分析表明,Ca2+-free形式的CaM能够明显促进CopC催化活性,增进与底物caspase-3的结合能力。这一发现与宿主细胞静息状态处于低钙环境是一致的。研究人员在细胞中上调或下调钙调蛋白的表达量,对病原菌感染时CopC的活性有对应的调控作用。紫色色杆菌感染小鼠模型中也表明CopC与CaM的结合能力,对病原菌在小鼠肝脏的定殖和对小鼠的感染致死能力至关重要。
综上所述,该研究解析了CopC对配体/底物/辅因子的识别机制、CopC对底物进行ADPR-deacylization修饰的催化机制以及反应完成后底物的分离机制;完整揭示了CaM在低钙环境下,通过调节CopC结构而促进其酶学活性的分子机制,证实CaM在病原细菌感染时协助毒力蛋白发挥功能。
南方科技大学医学院傅暘课题组张阔博士、田苗博士与华中农业大学李姗课题组博士研究生彭婷、陶新元为本文共同第一作者;李姗教授和傅暘副教授为本文共同通讯作者,南方科技大学为本文第一单位和通讯单位。本文共同作者、傅暘课题组硕士生王曌为文章绘制杂志封面。本项目在国家自然科学基金、深圳市科创委支持下完成。
论文链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(22)01060-7
供稿:医学院
通讯员:廖丹
编辑:曾昱雯




