近日,南方科技大学生物医学工程系先进显微成像课题组副教授李依明团队在三维全细胞大视场高通量超分辨成像领域取得重要进展,相关研究成果以 “Field-dependent deep learning enables high-throughput whole-cell 3D super-resolution imaging”为题在国际期刊Nature Methods上长文发表。

具有高对比度和超分辨率的荧光显微镜彻底改变了细胞生物学研究。此外,生物医学研究通常需要大量的统计分析才能得出具有高置信度的结论,具有丰富信息内容的高通量成像被广泛应用于定量生物学研究。一个新兴的趋势是发展用于高内涵筛选的高通量超分辨显微成像技术。研究团队基于宽场成像的单分子定位超分辨显微成像技术(single-molecule localization microscopy, SMLM),提出了一套针对空间移变点扩散函数(point spread function, PSF)精准定位的深度学习算法框架FD-DeepLoc(field dependent deep learning localization)。在180×180×5 µm3的范围内实现了无需扫描的全细胞超分辨成像,将三维SMLM的成像通量提升了约100倍。该工作为超分辨显微成像领域提供了新的技术思路和视角,对研究完整细胞群或组织中纳米级生物结构具有重要的理论意义和应用价值。
为了对大视场中的移变PSF进行精确建模,团队从适用于高数值孔径物镜的矢量PSF建模出发,构建了一套可描述任意位置像差的空间移变PSF模型。结合团队之前发表在NatureCommunications的全局拟合算法globLoc对不同z平面的点光源图片进行全局拟合,实现对像差的高精度估计。考虑到建模整个大视场空间移变的像差(21项泽尼克多项式系数表示)需要对整个视场进行上千次的采样,团队开发了领域内第一个基于GPU加速的矢量PSF模型拟合算法和像差校正软件,将校正速度提高了50倍,满足了大视场的PSF建模需求。
近年来,深度学习算法已被广泛应用于科学研究中。凭借出色的特征感知能力和端到端的图像拟合能力,深度学习在SMLM中展现出远超传统算法的性能。然而,传统的卷积神经网络对空间位置不敏感,光学像差通常是静态的并且与其位置高度相关。对于大视场成像,需要空间位置敏感的超分辨重建算法。为了克服视场相关的像差,团队在卷积神经网络中引入两个位置相关的通道,把位置相关的信息编码到神经网络里(图1)。FD-DeepLoc突破了传统卷积神经网络对空间位置不敏感的局限,在全画幅sCMOS相机(1608×1608)视场范围内对空间移变的单分子数据精准定位,实现了三维大视场高通量超分辨成像。
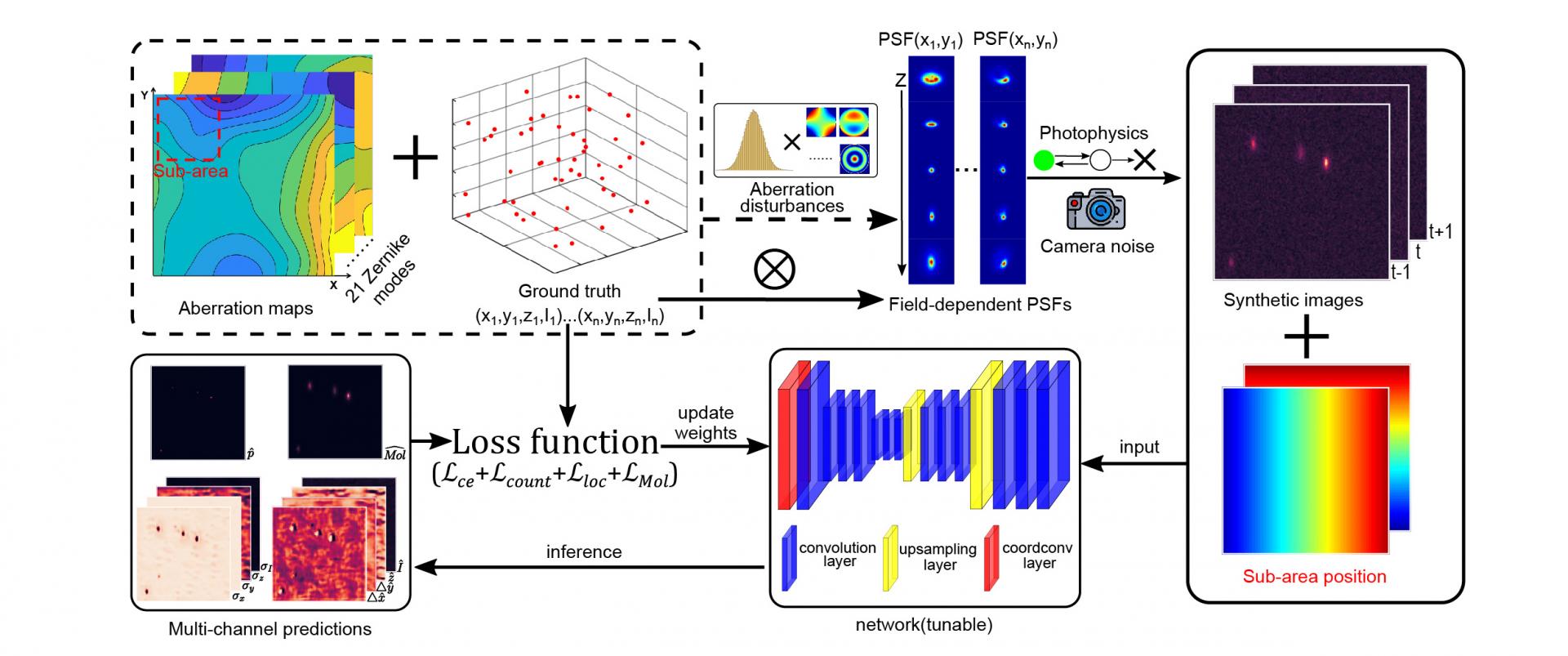 图1 FD-DeepLoc网络框架图
图1 FD-DeepLoc网络框架图
深度学习算法通常需要先验知识对网络进行训练。在FD-DeepLoc网络中,通过精确建模物理成像过程生成海量数据,有效避免了深度学习过拟合的问题。此外,FD-DeepLoc唯一的先验就是PSF模型,不需要预先知道生物样品的结构信息,所以无需对不同的样品重复训练网络。同时,FD-DeepLoc采用鲁棒训练策略和精准的背景建模,使得网络表现出更好的鲁棒性和精确率。在模拟和实验数据中(图2),FD-DeepLoc相对于目前领域内两个表现最好的算法——团队2018年在NatureMethods上发表的基于三次样条插值的传统单分子拟合Cspline算法和基于神经网络的DECODE算法,都有显著的提升。在三维超分辨定位精度指标均方根误差(root-mean-square error, RMSE)上相比于DECODE提升近两倍。此外,FD-DeepLoc包含的大视场空间移变的矢量PSF建模和基于深度学习的单分子定位算法提供开源(https://github.com/Li-Lab-SUSTech/FD-DeepLoc )。
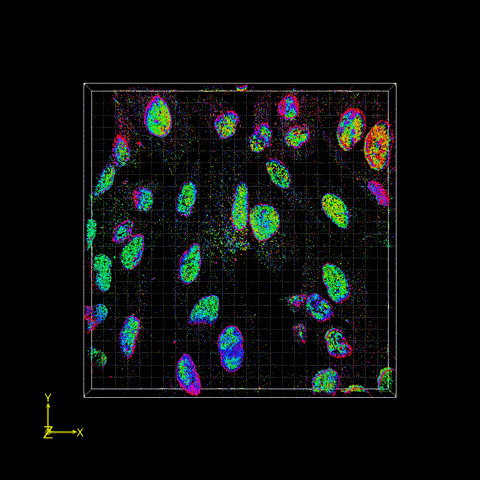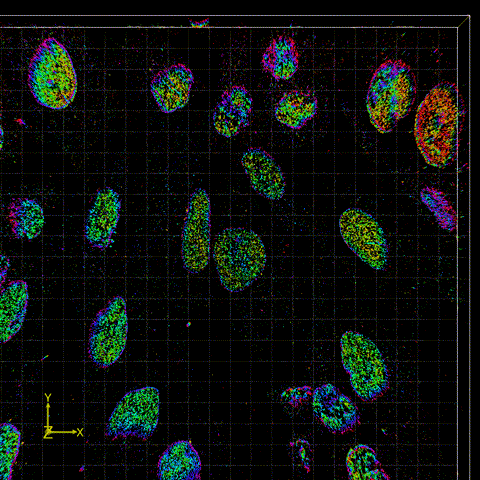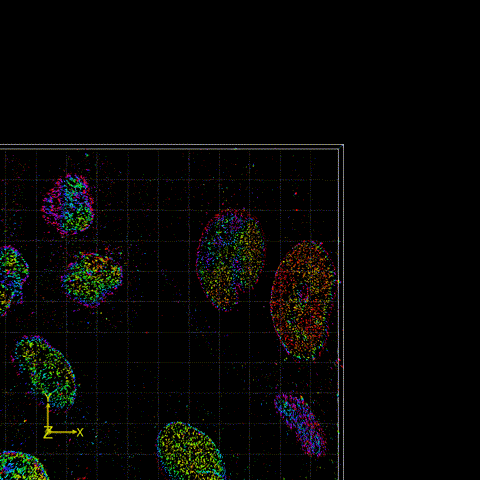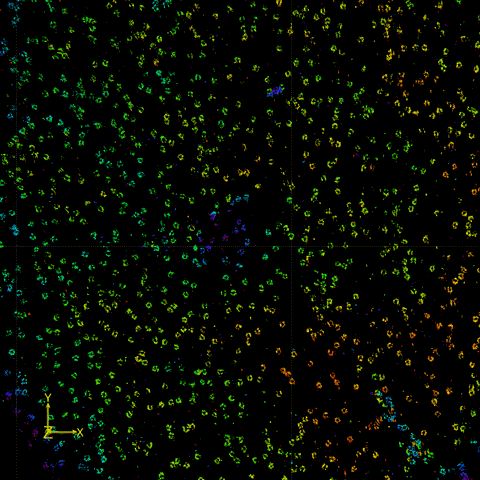
图2 FD-DeepLoc用于分析大视场下核孔复合物实验数据
大视场成像可以用来对大尺寸样品进行研究。体外培养神经细胞通常都在几百微米的范围内生长,传统的超分辨成像一般只能看到小于50 µm的轴突片段,往往忽略掉一些不常见的结构,而且无法在更大的尺度上观测神经元之间的精细互作信息。研究人员利用小鼠胚胎干细胞诱导的神经细胞,选用β2血影蛋白作为观测对象。利用传统散光调制的PSF进行三维超分辨成像(图3a-e),血影蛋白沿神经突触的周期性组织清晰可见。然而,传统散光PSF的景深受限在1 μm左右,离焦处的神经突结构有部分图像丢失(图3d-e)。为了拓展轴向成像范围,团队提出了一种以可变形镜促动器响应函数为基函数的相位设计框架,优化得到了一系列基于可变形镜的三维精度最优PSF(DM-optimized PSF, DMO PSF),实现自由景深控制。对于神经细胞的成像实验,采用可变形镜优化的3µm景深DMO PSF进行数据采集,即使在具有大直径的神经突中,也可以很好地重建血影蛋白的三维分布(图3f-j)。
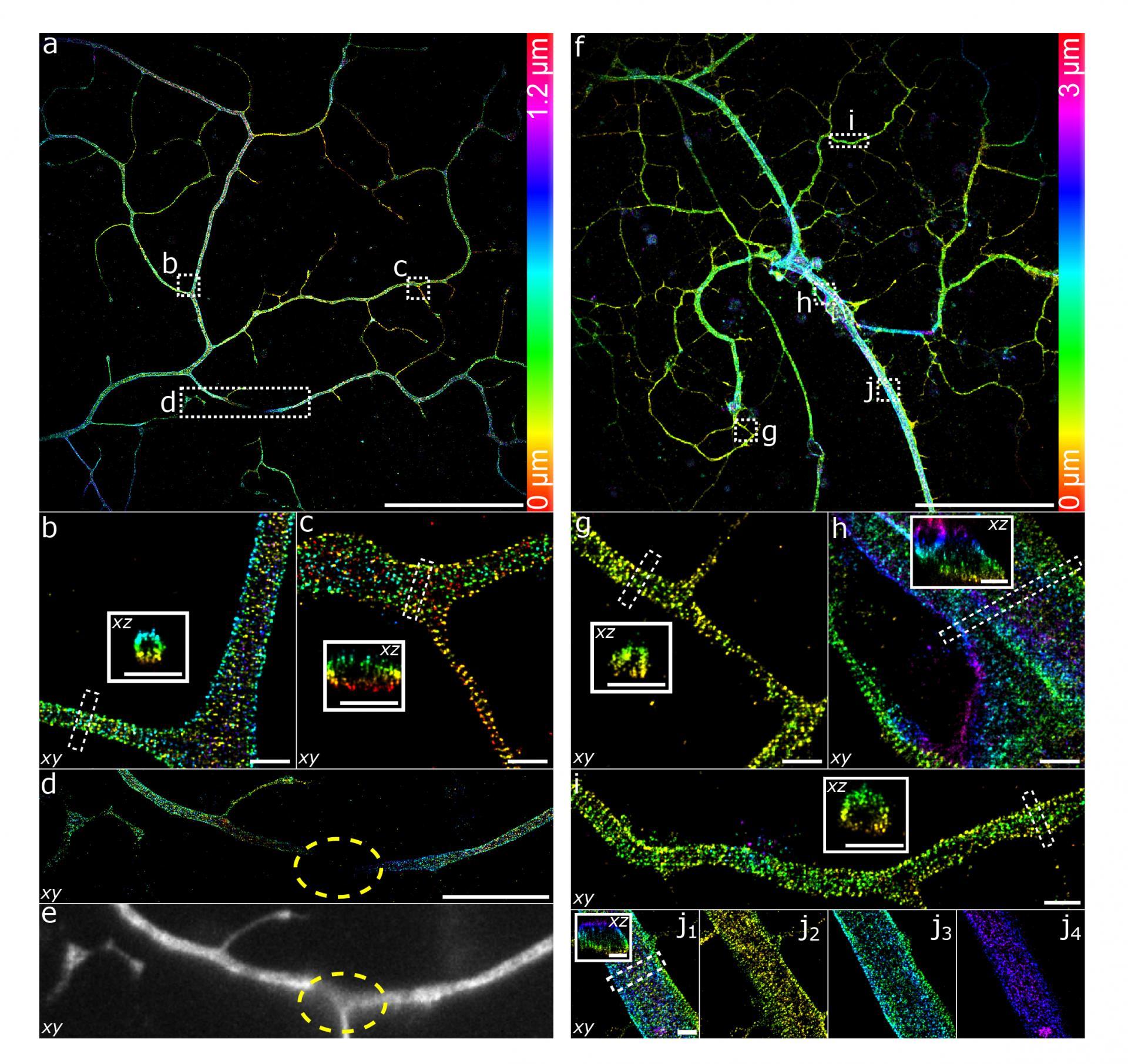 图3 β2血影蛋白在神经细胞中的三维超分辨成像。比例尺,50 μm (a,f),10 μm(d),1 μm(b,c,g–j)
图3 β2血影蛋白在神经细胞中的三维超分辨成像。比例尺,50 μm (a,f),10 μm(d),1 μm(b,c,g–j)
大视场成像也带来了数据通量的提升。得益于高通量成像的能力,研究人员利用 FD-DeepLoc可以在短时间内采集到上百个不经过人工挑选的全细胞线粒体超分辨图像。如图4所示,研究人员在16个感兴趣的视场区域,利用FD-DeepLoc重建出121个全细胞线粒体三维超分辨图像(图4a)。通过提取这些细胞的形态(分叉、长度、球形度等)进行聚类分析,得到三种不同类型的线粒体细胞。如图4b所示,类型1细胞包含更多的小圆形线粒体和更少的分支结构;类型2细胞包含延伸的管状线粒体和更复杂的网络结构;类型3细胞含有球形和管状线粒体的混合物结构。精细的全细胞结构超分辨分析为细胞组学提供了新思路。
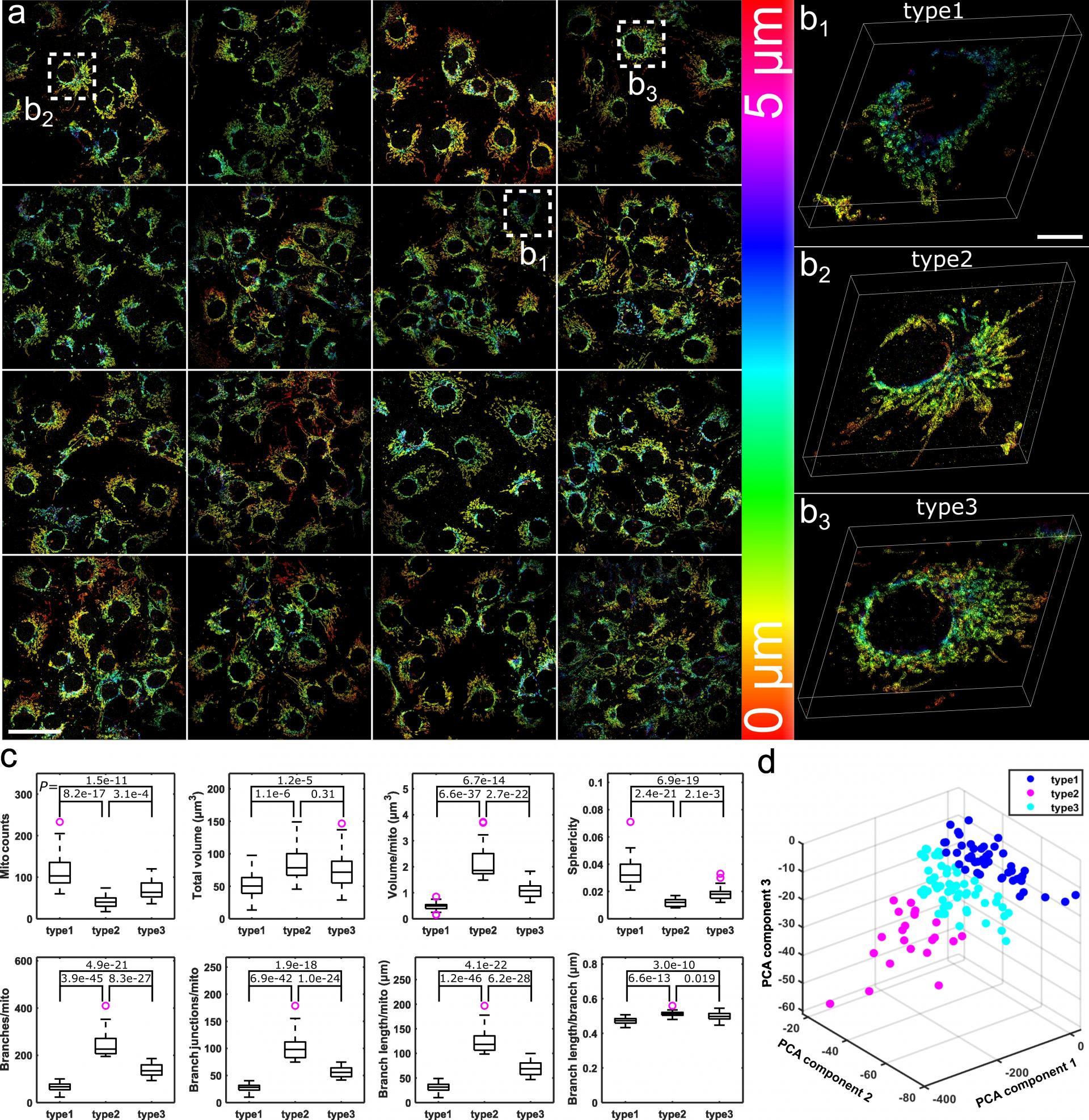
图4 全细胞三维超分辨线粒体图像的定量分析。比例尺,50 μm(a),10 μm(b1)
南方科技大学生物医学工程系博士生傅爽、石伟为论文的共同一作,李依明为该论文通讯作者,南科大是论文第一单位。该项目得到了山东省重点研发计划,深圳市孔雀团队和南方科技大学启动资金等科研项目的支持。
论文链接:https://www.nature.com/articles/s41592-023-01775-5
供稿:生物医学工程系
通讯员:肖然
主图:丘妍
编辑:朱增光




