
近日,南方科技大学化学系副教授陈顺兴(Chris Soon Heng TAN)课题组关于高通量药物靶点筛选技术揭示细胞特异性药物-靶点相互作用研究工作取得重要进展,相关成果以“Target deconvolution with matrix-augmented pooling strategy reveals cell-specific drug-protein interactions”为题发表在学术期刊Cell Chemical Biology上。该研究提出一种高通量的混检策略(MAPS)以鉴定药物的靶点,通过该方法分析5种细胞系药物-靶点相互作用结果,揭示了在不同细胞系之间的靶点和结合亲和力有差异,并且进一步验证了BRAF和CSNK2A2分别是巴非替尼(bafetinib)和阿西贝利(abemaciclib)的潜在脱靶靶点。
随着分子生物学技术的发展和人类基因组计划的完成,发现了大量可供研究的新型分子靶点,但并不是所有的靶点都与疾病发展进程相关,在新药研发的过程中靶点的选择与验证至关重要,也是新药创新的前提和保障。虽然对于疾病发生的生物学机制研究发展迅速,但是新药靶点的发现仍然是一项高成本且费时费力的过程。
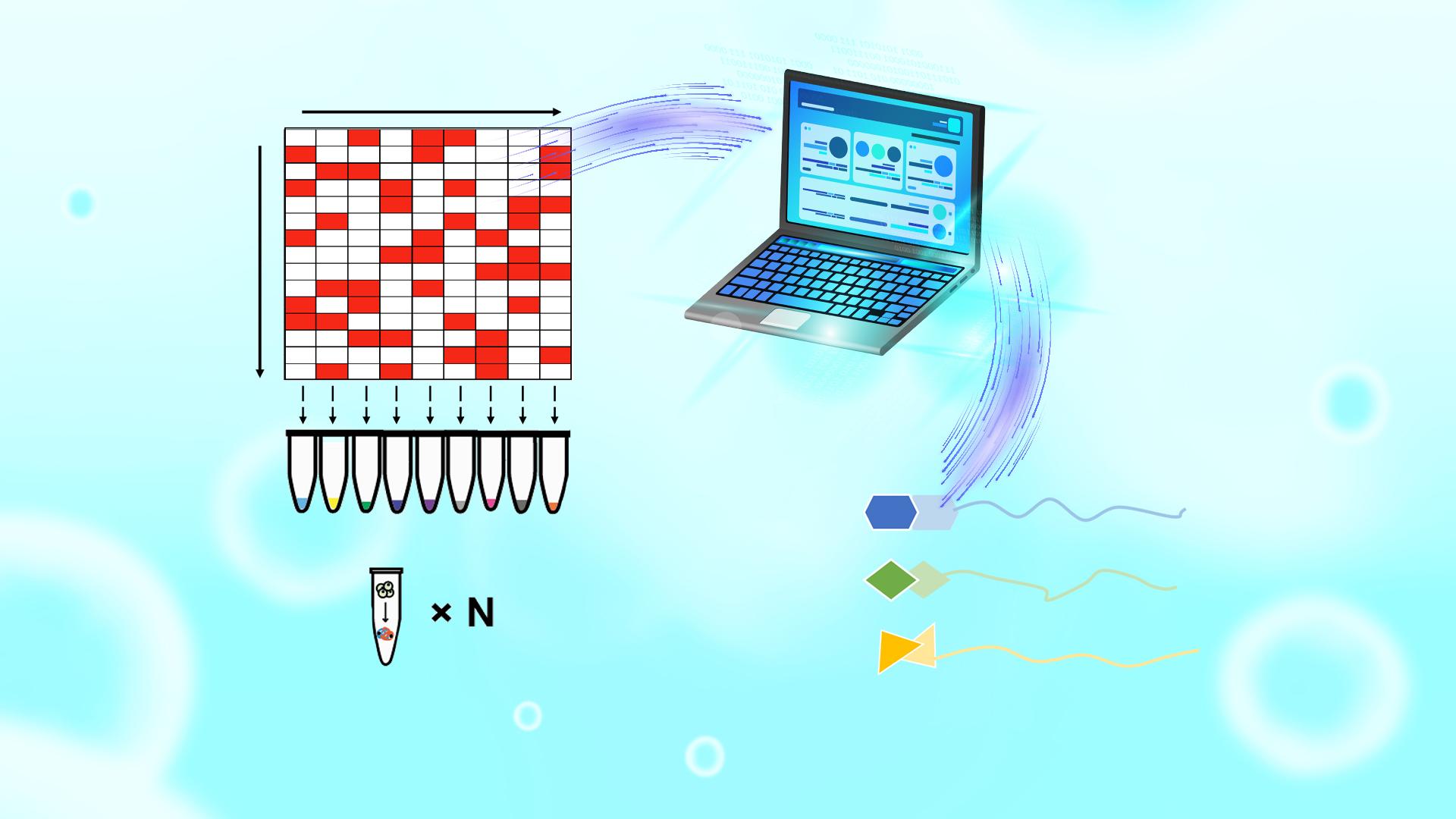
针对上述问题,陈顺兴领导的团队开发了一种高通量混合策略,称为矩阵增强池策略(MAPS)。这一策略包括优化混合物中多种药物的排列,并以数学方法处理混合物以同时描述每种药物的靶标(图1)。该技术包括三个主要步骤: 1)优化药物的排列以确保组间高度正交性,每个组中的化合物数量相似或相等,每个化合物至少在三个组中存在; 2)基于排列矩阵创建测试药物的多个混合系统,并使用iTSA单温点加热获得蛋白质热稳定性转换结果; 3)分析质谱法结果以确定药物靶标。
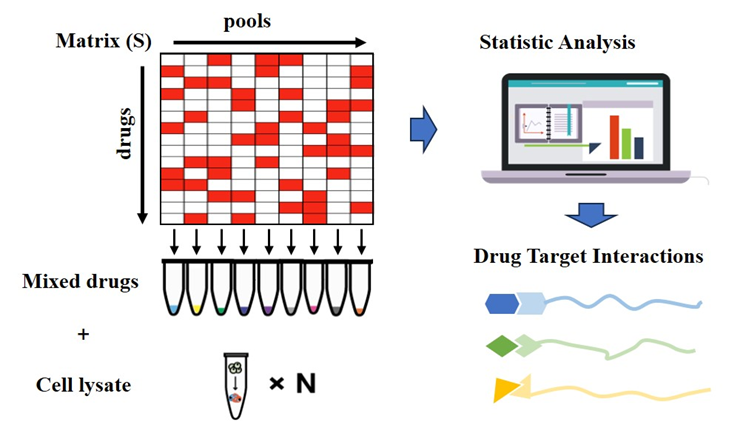
图1 MAPS流程示意图
研究人员通过15种药物的热蛋白质组分析(TPP)测试验证了这一策略。该策略使得实验通量增加了60倍并降低了90%的成本,这对于大规模筛选药物靶点提供了良好的方法途径。通过在K562、MCF7、HEK293T、HCT116、HepG2五种细胞系进行同样一组MAPS实验,其中包括5种作用机制模糊的潜在脱靶药物。MAPS-iTSA分析揭示了不同细胞系药物-靶标的相互作用亲和力不同(图2),通过对不同细胞系的数据分析得到了这些药物的许多新的潜在脱靶点。
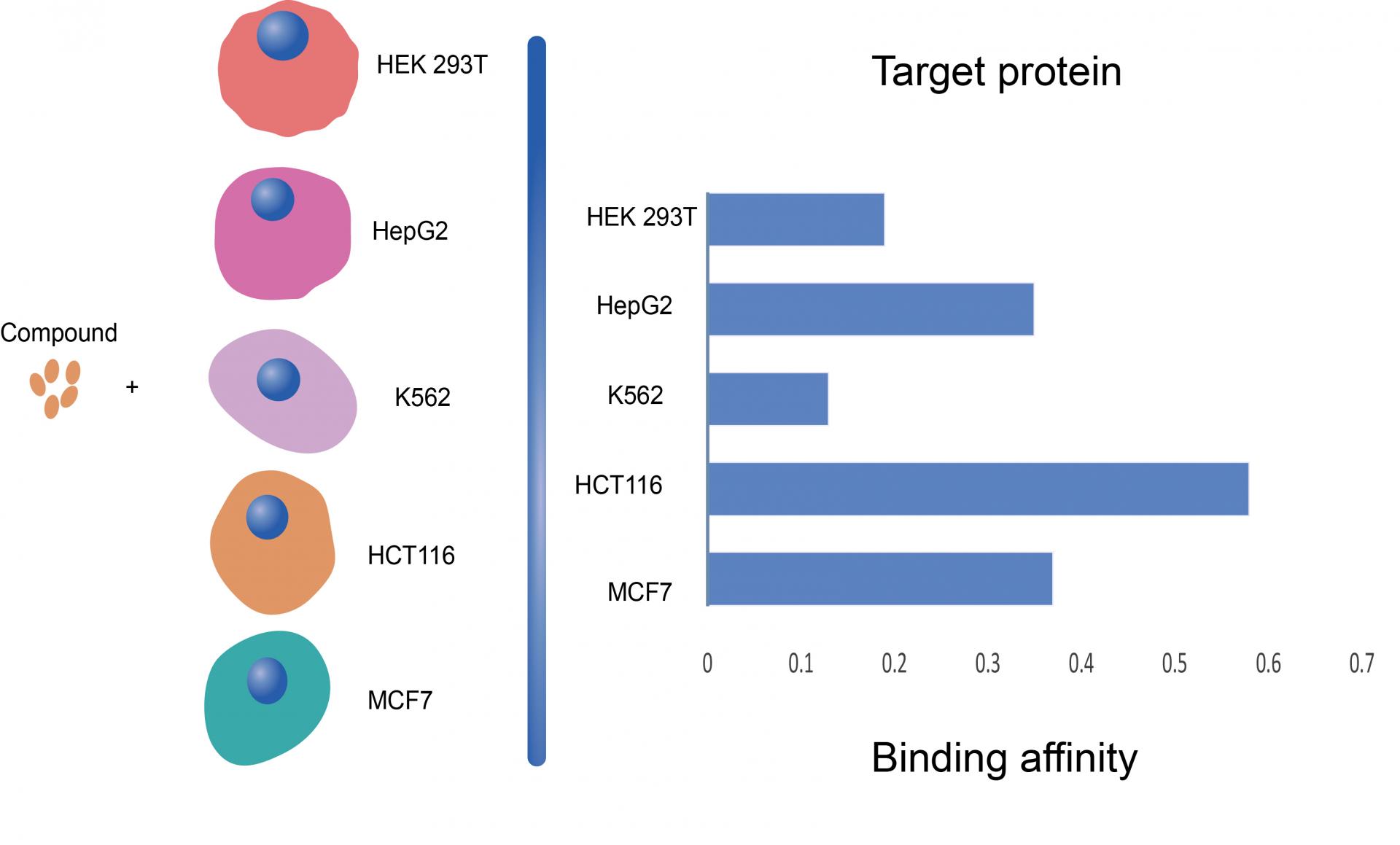
图2 不同细胞系药物-靶标的相互作用亲和力不同
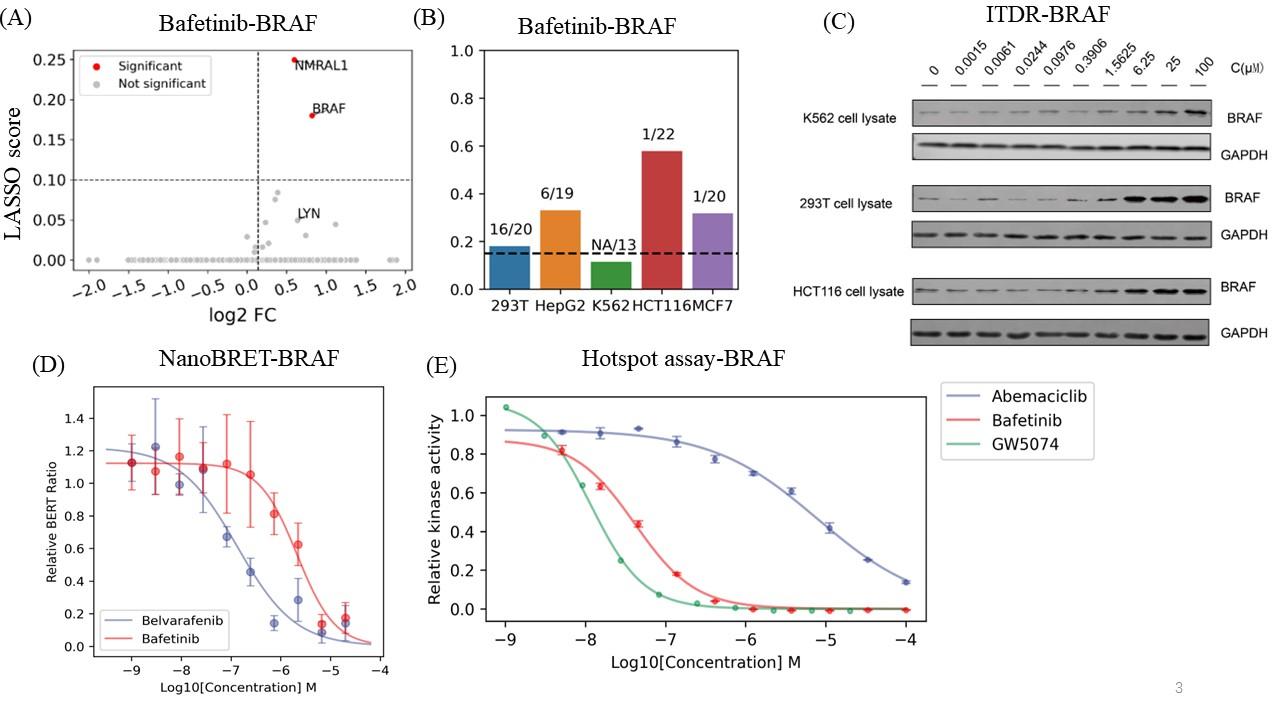
图3 脱靶解释和验证
A.巴非替尼药物的靶点火山图。B.不同细胞系中Bafetinib-BRAF的亲和力。C. 不同细胞系中Bafetinib-BRAF的剂量依赖性免疫印迹图。d. NanoBERT细胞内脱靶Bafetinib-BRAF剂量反应曲线。e. Bafetinib-BRAF体外脱靶验证的激酶活性剂量反应曲线。
研究人员分析表明,针对BCR-ABL和LYN治疗淋巴细胞白血病的实验性药物巴非替尼(Bafetinib)可以结合BRAF。并且在不同的细胞系中Bafetinib-BRAF的亲和力不同,通过ITDRFCETSA(等剂量依赖曲线)验证得到与质谱数据相匹配的结果。经过NanoBRET(细胞内激酶检测)及Kinase hotspot assay(放射性同位素标记ATP法)验证了BRAF可能是巴非替尼的潜在靶点(图3)。除此之外研究人员也同样验证了CSNK2A2是阿西贝利的潜在靶点。该策略这对于分析细胞类型的药物-靶标亲和力及大规模筛选药物靶点提供了良好的方法途径。
综上所述,由南方科技大学的陈顺兴团队领导的研究在高通量药物靶标筛选技术方面取得了重要进展,特别是在研究细胞特异性药物靶标相互作用方面。他们创新的矩阵增强汇集策略(MAPS)为确定药物靶点提供了一种有价值的方法,并在新药开发中具有潜在的应用。
南方科技大学化学系博士后纪宏超(现为中国农业科学院深圳农业基因组研究所副研究员)和南方科技大学2019级博士生陆雪为论文共同第一作者,陈顺兴为第一通讯作者,南科大为论文第一单位。合作单位还包括美国加州大学、牛津大学纳菲尔德医学院。该研究得到了深圳市科技创新委员会基金项目和国家自然科学基金委员会的支持。
论文链接:https://doi.org/10.1016/j.chembiol.2023.08.002
供稿:化学系
通讯员:吴笑弟
主图:丘妍
编辑:朱增光




