EB病毒(Epstein-Barr virus)是一种广泛易感的人类疱疹病毒。它是一种双链DNA包膜病毒,也是首个被发现的人类致瘤病毒。EB病毒是造成传染性单核细胞增多症(IM)的病原体,并与鼻咽癌、部分胃癌和多种淋巴瘤及多发性硬化症等自身免疫性疾病发病相关。但是目前为止,国际上仍未有任何一款针对EB病毒的预防性疫苗上市。EB病毒的病毒膜上存在多个病毒糖蛋白,它们通过与对应受体的结合,协同介导病毒感染宿主细胞。其中关键糖蛋白gB是病毒的融合蛋白,能够与宿主细胞膜表面病毒受体结合,并接收来自其他病毒糖蛋白的信号,触发病毒与细胞膜的融合。虽然gB是潜在的EB病毒理想疫苗靶标,但是其体液免疫激活效应弱、免疫效应时间短、中和抗体诱导能力不足阻碍了其作为疫苗的进一步研究与应用。
2023年10月16日,中山大学肿瘤防治中心教授曾木圣、钟茜与南方科技大学冷冻电镜中心教授刘铮团队在Cell子刊Cell Host &Microbe(2023年IF 30.3)上在线发表题为A gB nanoparticle vaccine elicits a protective neutralizing antibody response against EBV的研究论文。该研究通过结构设计并体外表达组装出表面展示gB的纳米颗粒疫苗,证明其在具有良好的抗原性和稳定性的同时,还能够高效诱导EB病毒中和抗体的产生,为后续EB病毒疫苗的研发奠定了重要的基础。
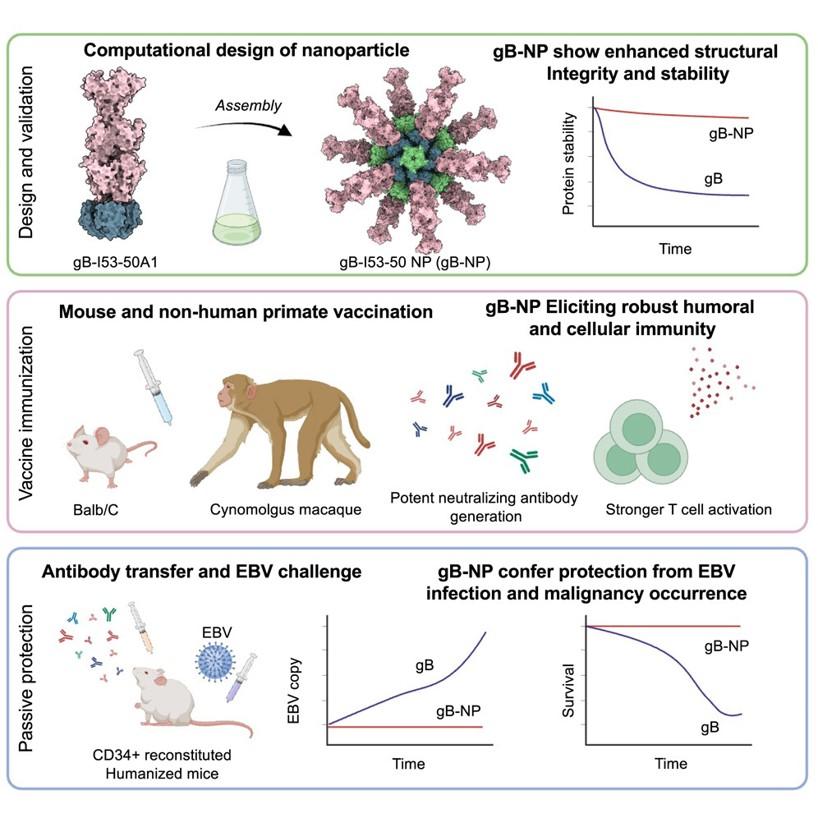
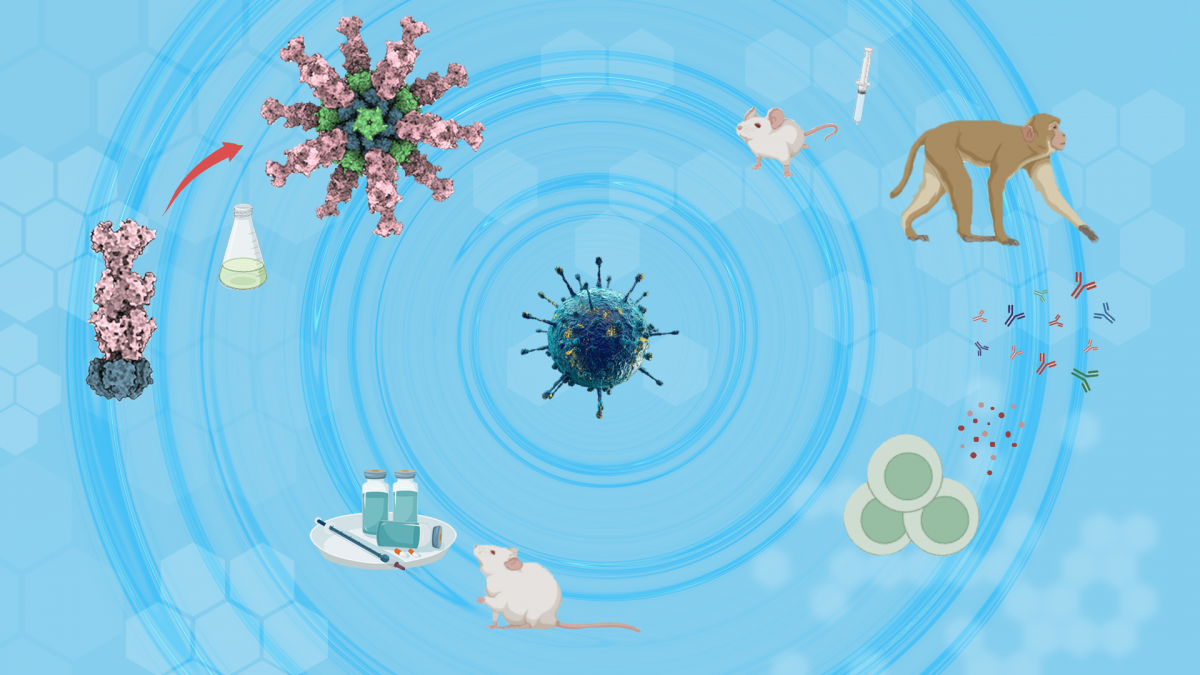
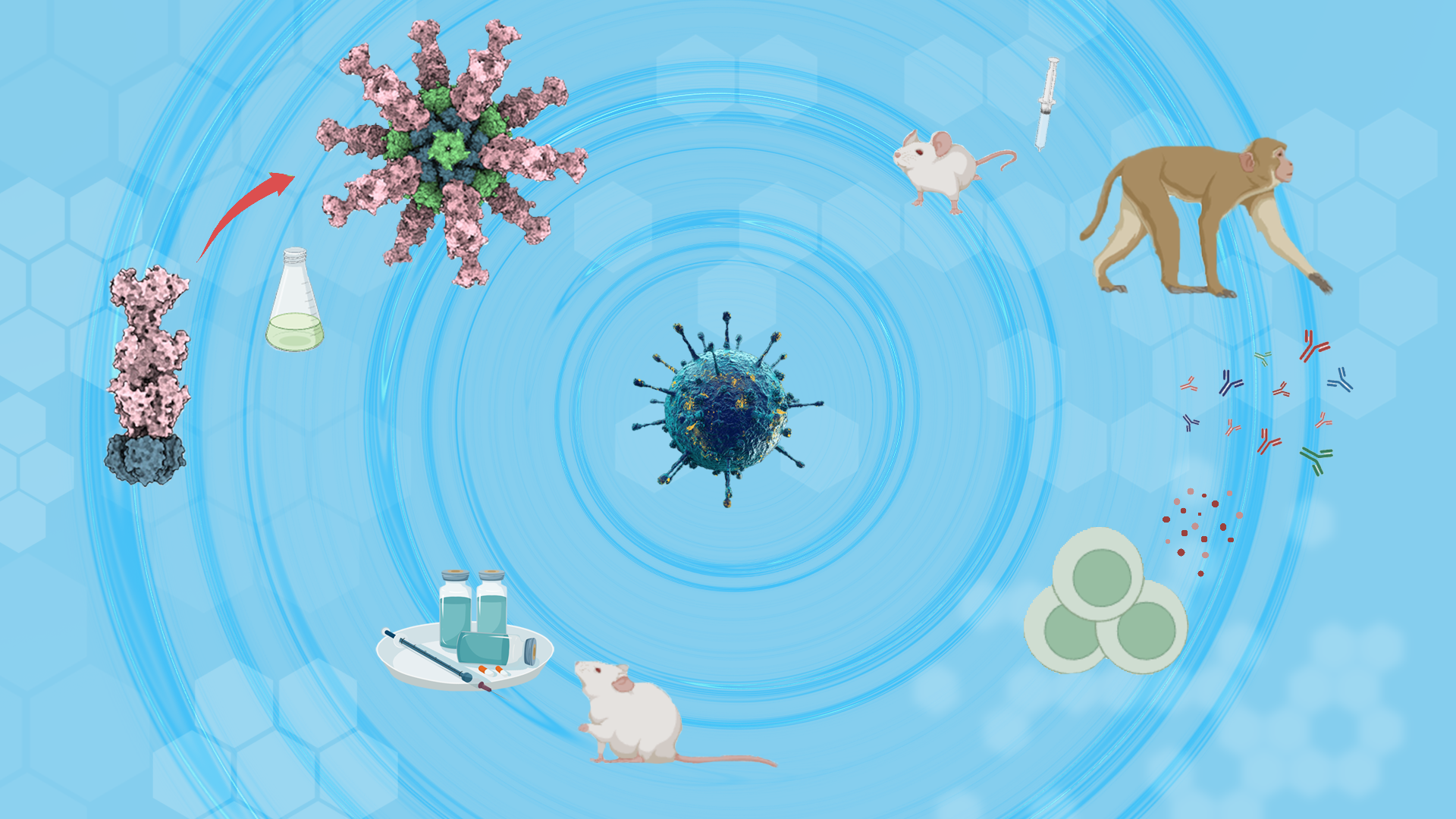
图1. gB-I53-50纳米颗粒疫苗设计和验证思路
本研究首先利用计算机同轴对接,计算了gB与多个不同的纳米颗粒骨架蛋白的最优链接间距,并根据计算模型设计了表面展示gB的纳米颗粒gB-I53-50 NP,通过体外组装并经过生物化学和结构生物学的验证,证实该纳米颗粒成功表达并能够在表面展示EB病毒的gB蛋白。
随后研究人员使用蛋白内在荧光扫描和生物膜干涉等手段,明确该疫苗在提高gB抗原的抗原性的同时,纳米颗粒显示出在4°和室温下良好的稳定性,为疫苗的制备和运输奠定了重要的稳定性基础。
应用单颗粒冷冻电镜技术和冷冻电子断层成像技术,研究人员对纳米颗粒gB-I53-50 NP进行了结构解析,高分辨的结构显示gB-I53-50 NP纳米颗粒的结构完整性,以及gB蛋白在纳米颗粒表面的结构的完整性和摇摆的柔性。
利用小鼠和非人灵长类动物免疫实验,研究人员发现该疫苗在保持良好的免疫安全性的前提下,相比于传统的亚单位蛋白疫苗能够更高效诱导针对EB病毒的中和抗体,并同时抑制EB病毒上皮细胞和B细胞感染,以及诱导更强的T细胞激活杀伤能力。进一步利用人源化小鼠模型,研究人员发现gB纳米颗粒疫苗在猴体诱导的血清多克隆抗体能够显著保护人源化小鼠免于EBV感染及淋巴瘤发生,该保护效应在猴免疫10周后仍具有持续存在,证实该疫苗具有诱导强烈、长效中和保护抗体的效果。因此,这一纳米颗粒蛋白疫苗是具有显著临床转化潜力的下一代EB病毒候选疫苗,而且为其他致病性疱疹病毒疫苗研发提供重要的思路。
中山大学肿瘤防治中心孙聪博士、中山大学肿瘤防治中心康银峰博士、南方科技大学生命科学学院博士研究生房昕燕和中山大学肿瘤防治中心刘依娜博士为本文的共同第一作者。曾木圣、刘铮、钟茜为本文的共同通讯作者。该研究获得国家自然科学基金重点项目、国家重点研发计划等基金支持。
论文链接:https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(23)00378-5
供稿:冷冻电镜中心
通讯员:和思淼
主图:张为创
编辑:朱增光




