2023年12月5日,南方科技大学医学院药理学系助理教授李婉秋课题组与中山大学医学院副教授温增麒课题组合作在Cell Discovery以长文形式在线发表了题为”Structural basis of nucleosomal H4K20 recognition and methylation by SUV420H1 methyltransferase”的研究论文。该研究报道了SUV420H1蛋白分别与经典核小体、H2A.Z核小体的复合物高分辨率冷冻电镜结构,揭示了SUV420H1基于核小体为底物的特异性识别和甲基化组蛋白H4K20的分子机制,以及H2A.Z核小体增强SUV420H1结合从而促进其催化活性的机理,为更好的理解与SUV420H1相关的人类疾病奠定了分子基础。
真核生物细胞中,基因组DNA与组蛋白相互作用形成核小体串珠形式的染色质,以储存遗传信息。核小体串珠可以进一步折叠成更高级形式的染色质结构。核小体由146 bp的DNA包裹在组蛋白八聚体(H2A,H2B,H3,H4)2上,在DNA的复制、转录和修复中起着关键作用。核小体上的组蛋白发生翻译后修饰,从而调节染色质开放状态来调控基因的表达,与疾病的发生发展具有密切的关系。
SUV420H1是SUV4-20H家族蛋白中的一员,负责催化H4K20me2和H4K20me3修饰。研究发现,含有组蛋白变体H2A.Z的核小体能够通过直接结合SUV420H1,促进核小体上的H4K20位点发生二甲基化修饰,进而促进招募复制前体复合物中的ORC1,从而帮助染色质上复制起始位点的选择。已知SUV420H1可以识别核小体,使组蛋白H4K20位点可以被二甲基化。然而,这一过程的分子机制尚未清楚,并且含有组蛋白变体H2A.Z的核小体如何促进SUV420H1的H4K20催化活性仍然未知。
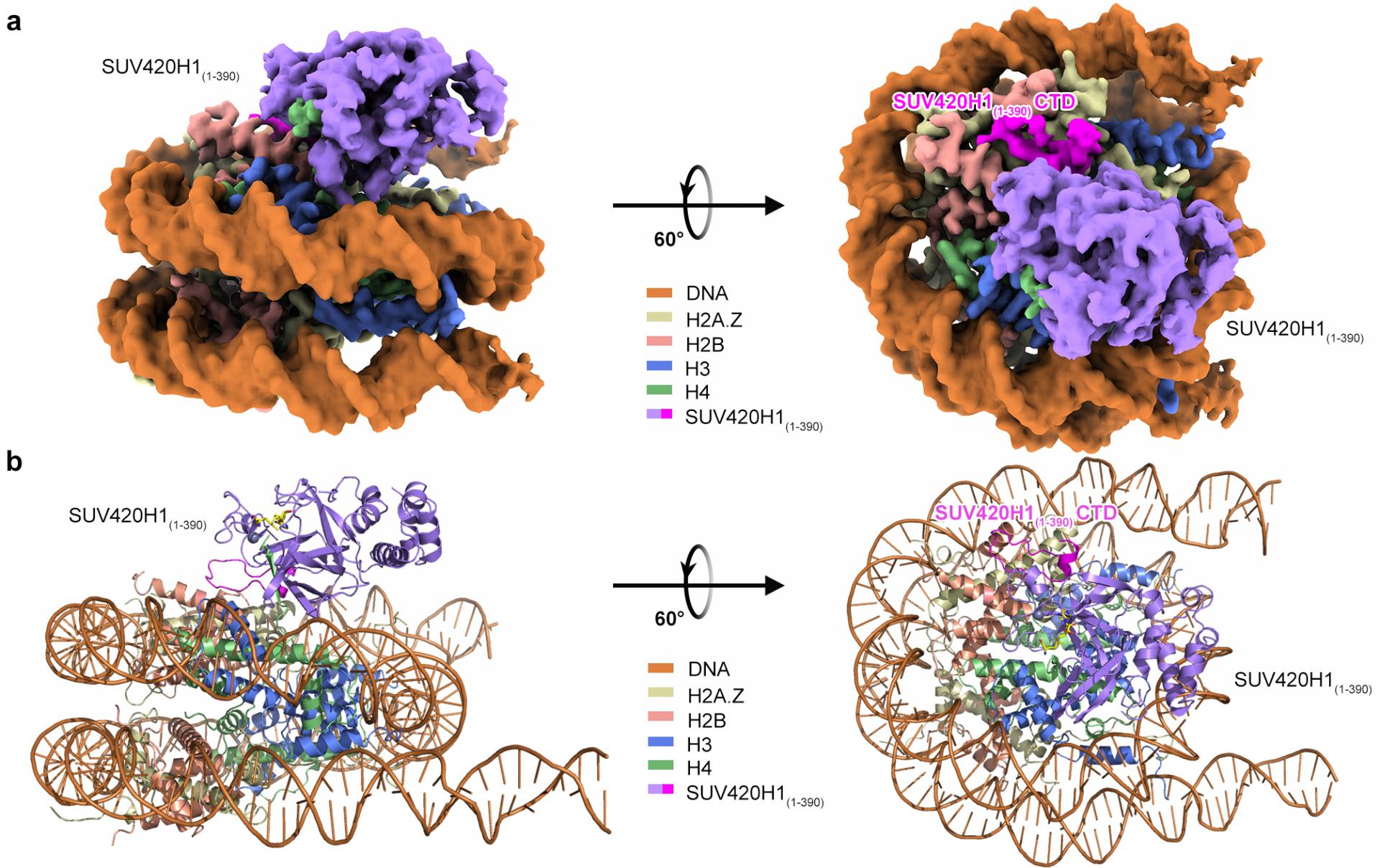 图1 SUV420H1-H2A.Z核小体复合物整体结构图(a 冷冻电镜结构电子密度图,b 原子模型图)
图1 SUV420H1-H2A.Z核小体复合物整体结构图(a 冷冻电镜结构电子密度图,b 原子模型图)
该研究分别解析了SUV420H1-H2A经典核小体复合物和SUV420H1-H2A.Z核小体复合物的冷冻电镜结构(图1)。在这两种复合物结构中,研究人员观察到SUV420H1与核小体上的DNA、H4的N端尾部以及H2A/H2A.Z-H2B酸性区域发生相互作用。具体而言,R286与核小体DNA相互作用,而SUV420H1中保守的精氨酸锚R352和R357则作用于核小体H2A/H2A.Z-H2B酸性区域。此外,S255和S283位于组蛋白H4尾巴入口处,相关的突变S255F和S283L,与乳腺癌和肺腺癌有关,具有较大的侧链,阻碍了H4尾巴插入到SUV420H1催化口袋,从而抑制了SUV420H1的甲基化活性(见图2a、2d)。基于对SUV420H1与核小体复合物结构的信息,研究人员进行了一系列突变设计,发现这些突变导致了SUV420H1催化活性和结合能力的不同程度降低(见图2b、2c)。
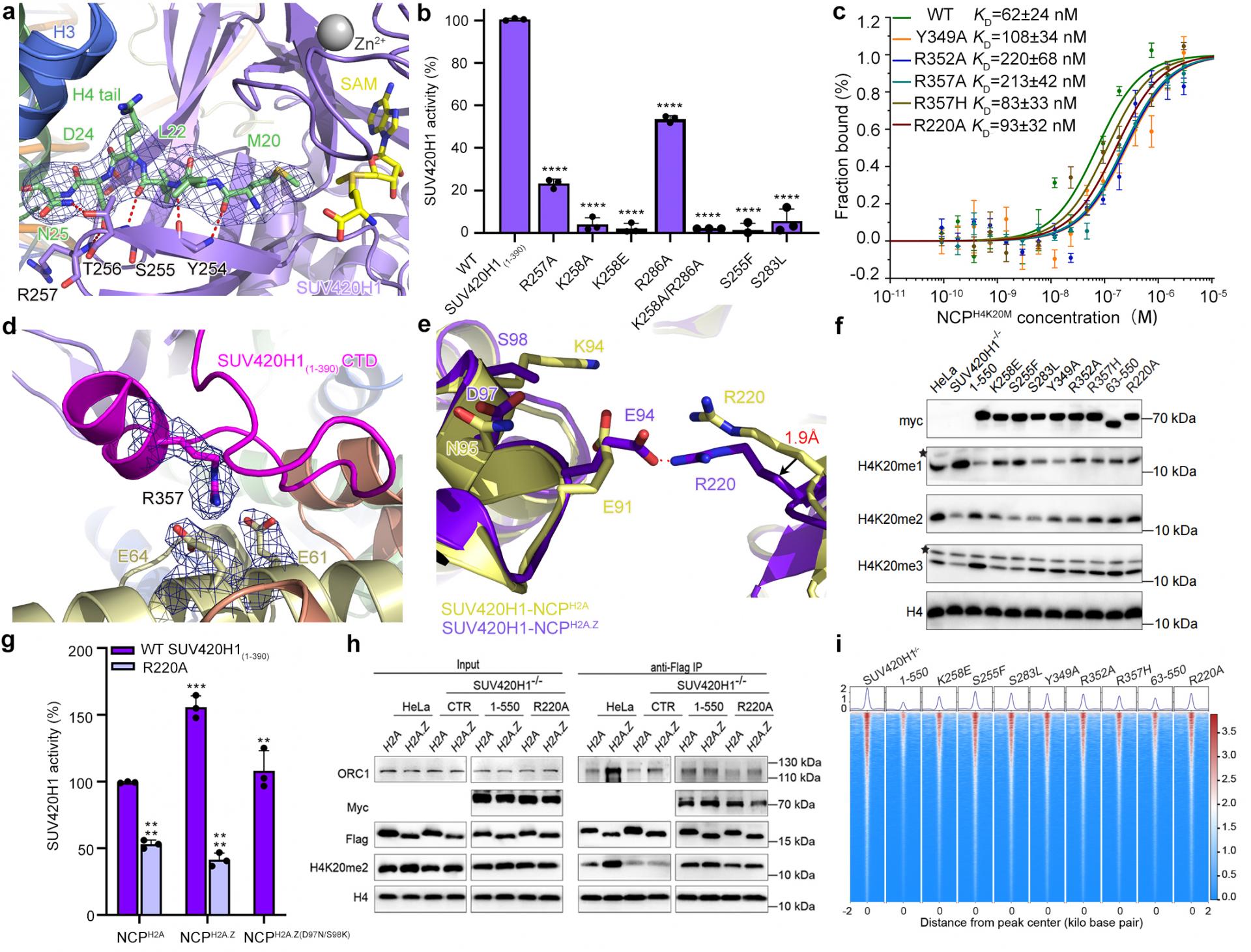
图2 SUV420H1与核小体相互作用界面以及体内外功能验证
特别值得注意的是,通过比较SUV420H1-H2A核小体复合物和SUV420H1-H2A.Z核小体复合物的结构,研究人员观察到与H2A/H2A.Z酸性区域相对应的氨基酸残基R220发生了轻微的构象变化。在SUV420H1-H2A.Z核小体复合物中,R220和E94之间的距离相较于SUV420H1-H2A核小体复合物中R220和E91之间的距离更为接近。通过体外生化实验和细胞免疫沉淀实验,研究人员进一步证实R220在调节H2A.Z核小体增强SUV420H1活性中发挥关键作用。此外,ATAC-seq实验进一步揭示了影响SUV420H1催化活性降低的位点,包括R220A突变在内,也会对染色质的开放性产生影响(图2)。
总体而言,该研究揭示了SUV420H1识别经典核小体和H2A.Z核小体并催化组蛋白H4K20甲基化修饰的结构基础。此外,研究人员还确定了促进H2A.Z核小体增强 SUV420H1催化活性的相互作用界面和关键氨基酸残基。这为进一步研究SUV420H1的功能及其在染色质调控中的作用提供了坚实基础。
南方科技大学医学院博士研究生林佛兰为本论文第一作者,李婉秋和温增麒为本论文共同通讯作者。深圳湾实验室-首都医科大学联合培养博士研究生张茹鑫,以及南方科技大学医学院药理学系研究生邵维汉、雷聪、马明希、张颖参与了该研究工作。南科大为论文第一单位。此项研究得到了国家自然科学基金和深圳市科创委的资助。项目得到了南方科技大学科研公共服务平台冷冻电镜中心的大力的支持。
论文链接:https://www.nature.com/articles/s41421-023-00620-5
供稿:医学院
通讯员:廖丹
主图:丘妍
编辑:朱增光




