
近日,南方科技大学医学院生物化学系鄢仁鸿课题组在Nature Structural & Molecular Biology期刊在线发表最新研究成果,题为“Structural insight into the assembly and working mechanism of helicase-primase D5 from Mpox virus” (“猴痘病毒解旋酶-引发酶D5蛋白组装和工作机制的结构生物学研究”)。
 由猴痘病毒(monkeypox virus, mpox virus, or MPXV)引发的猴痘疫情引起了全球关注,国内目前尚未有针对猴痘病毒的疫苗和药物正式上市,亟需加强对该病毒的感染和致病机制的研究。D5蛋白被认为是猴痘病毒的解旋酶-引发酶,在病毒的复制和基因组脱壳中发挥至关重要的作用。
由猴痘病毒(monkeypox virus, mpox virus, or MPXV)引发的猴痘疫情引起了全球关注,国内目前尚未有针对猴痘病毒的疫苗和药物正式上市,亟需加强对该病毒的感染和致病机制的研究。D5蛋白被认为是猴痘病毒的解旋酶-引发酶,在病毒的复制和基因组脱壳中发挥至关重要的作用。

作者成功解析了猴痘全长D5蛋白多种状态的高分辨率冷冻电镜结构,这些结构揭示了在ATP水解过程中D5沿着单链DNA (single-stranded DNA, ssDNA) 移动的特征, 阐明了痘病毒中ATP水解与DNA解旋协同的分子机制。但由于目前对痘病毒复制机器的工作机制的了解尚且不足,因此极大限制了相关抗病毒药物的开发。该文将研究目光聚焦于猴痘病毒解旋酶-引发酶D5,由于它在不同痘病毒中高度保守,所以是很好的广谱抗病毒药物靶点。
针对D5的解旋活性,研究发现全长的D5没有持续性的DNA解旋活性,当截掉引发酶结构域或者破坏引发酶结构域与解旋酶结构域的相互作用之后,就检测到了持续性的DNA解旋活性(图1),这说明N端引发酶结构域对C端解旋酶活性起到了调控作用。
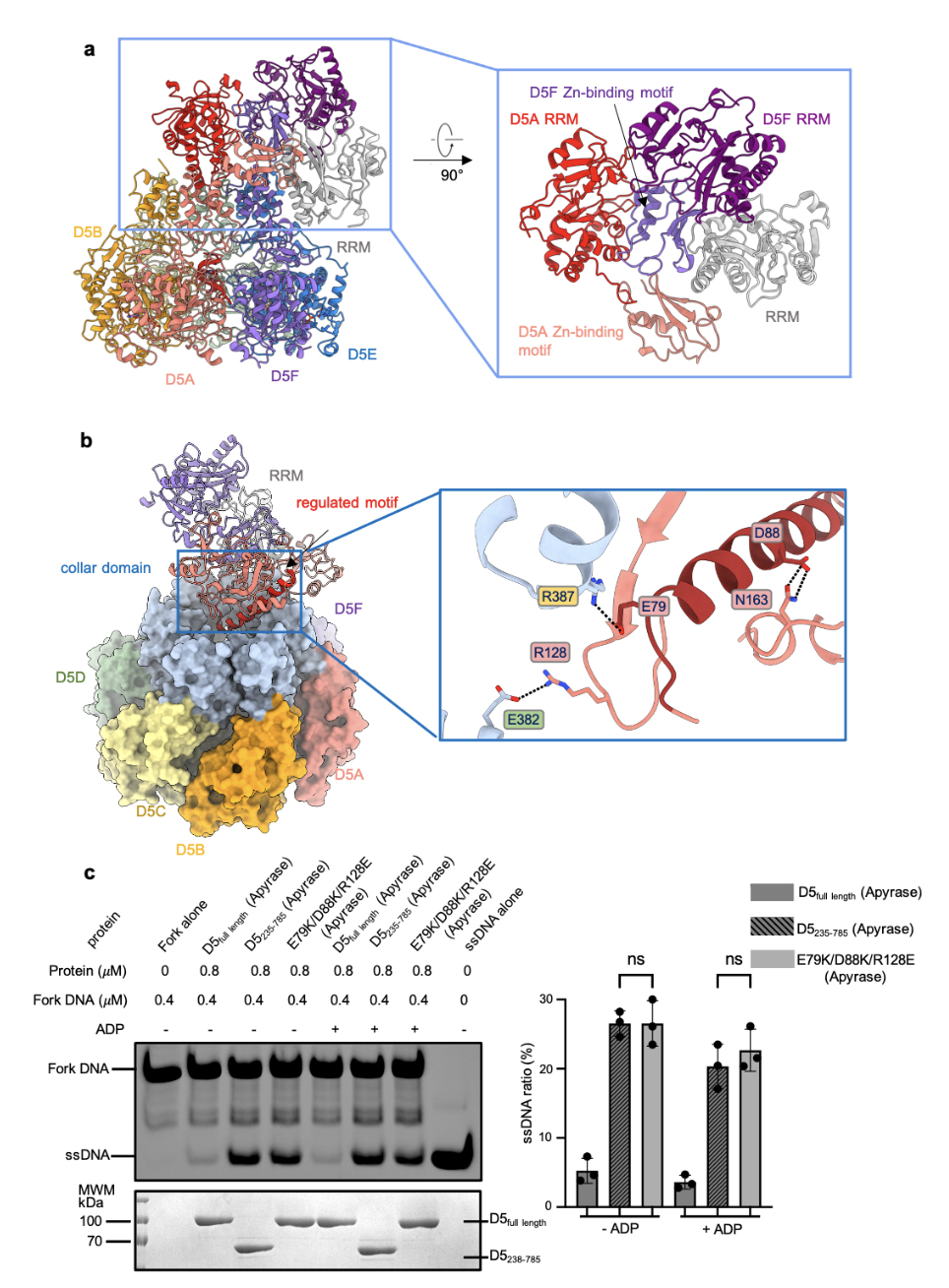
图1 D5的N端结构域结构和生化分析
在结构解析的过程中,研究团队捕捉到了DNA解旋过程的两个中间态通过与结合ATPgS的结构比较确定了两个中间态出现的先后次序,提出了6聚体D5通过消耗ATP,调控每个单体与相邻单体之间的相互作用,从而完成DNA解旋的过程的模型(图2)。
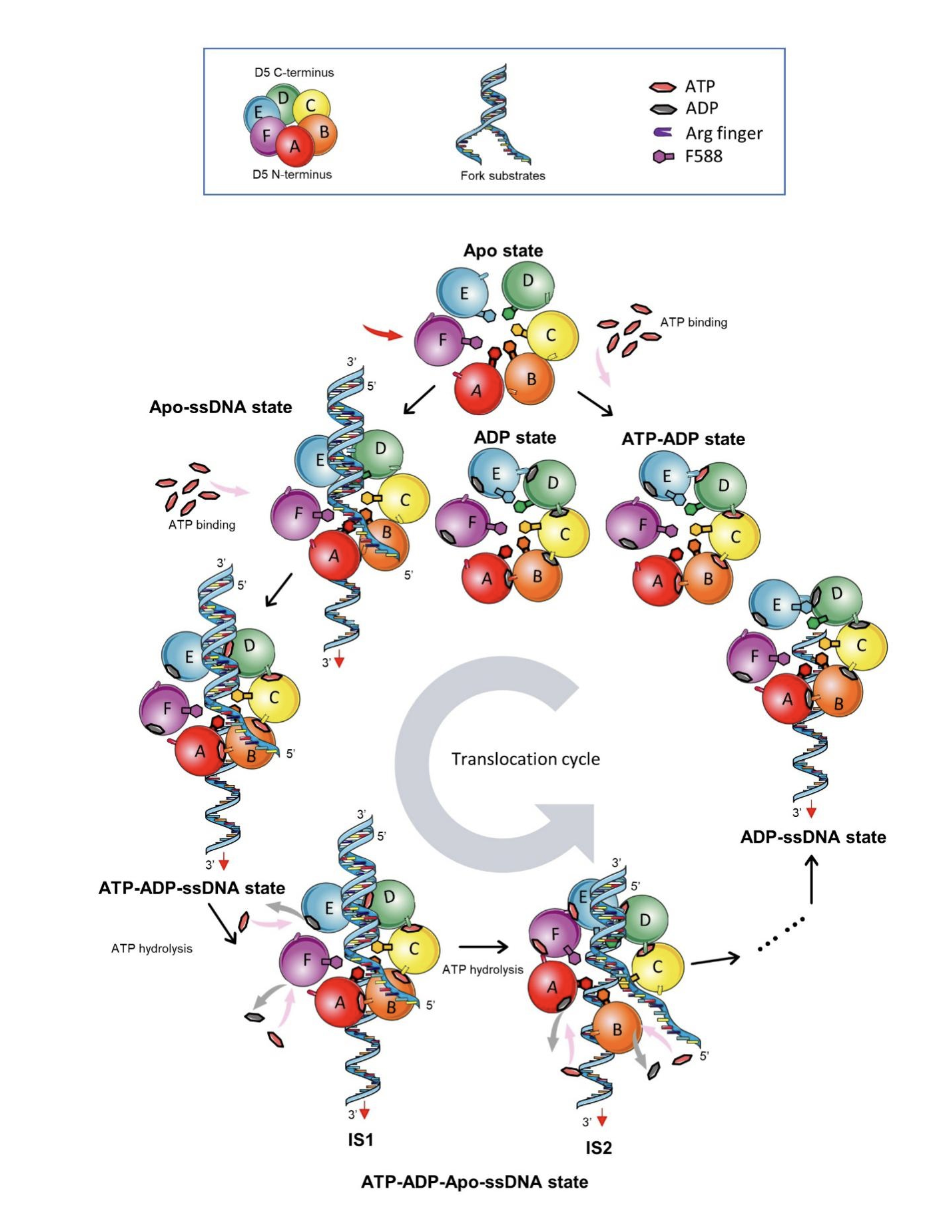 图2 D5工作过程的分子模型
图2 D5工作过程的分子模型
综上所述,该项研究发现了D5蛋白N端引发酶对C端解旋酶活性调控机理,阐明了痘病毒中ATP水解与DNA解旋协同的分子机制,为科学界对D5解旋机理的认识做出了重要贡献。值得一提的是,该项研究是鄢仁鸿团队在2023年初解析了猴痘病毒复制酶全酶组装和工作机制研究工作的后续,这些研究进一步加深了对痘病毒感染过程DNA复制机理的认识,为后续广谱抗痘病毒药物的开发提供了关键线索。
南方科技大学医学院生物化学系鄢仁鸿教授和原研究副教授郭莹莹(现为海南大学生命健康学院研究员)为该论文的共同通讯作者。清华大学博士研究生李雅宁和朱婧为该论文的共同第一作者。该项目受到南方科技大学高分辨电镜结构研究院和科研公共服务平台冷冻电镜机组、计算中心的支持。
论文链接:https://www.nature.com/articles/s41594-023-01142-0
通讯员:廖丹
供稿:医学院
主图:丘妍
编辑:韩文嘉




