近日,南方科技大学冷冻电镜中心王培毅教授团队联合中国科学院植物研究所光合膜蛋白结构生物学韩广业研究员团队及浙江大学张兴教授团队,利用冷冻电镜技术首次解析了A. marina光系统II-捕光天线(PSII-Pcb) 四聚体超大复合体的结构(图1)。该研究成果以“Structure of a unique PSII-Pcb tetrameric megacomplex in a chlorophyll d-containing cyanobacterium”为题,发表在国际学术期刊Science Advances上。
光合作用是光合生物将光能转化为化学能并将其储存在有机分子中的过程。叶绿素驱动的放氧光合作用主要发生在植物和藻类中,其中蓝藻是唯一进行放氧光合作用的原核光合生物,能在不同的环境,包括一些极端的环境条件下生长。蓝藻通常是以Chl a作为光系统中主要的捕光色素,大部分蓝藻以藻胆体作为捕光天线系统的主要部分。在所有的光合生物中,包括藻类和高等植物中的色素都是以Chl a为主的,在绿藻和高等植物具有膜内捕光天线,含有Chl a和Chl b。1996年,研究人员发现了一种以Chl d作为主要色素的蓝藻—Acaryochloris Marina (A. marina),并存在微量的Chl a和非典型的藻胆蛋白复合物结构,A. marina也是迄今为止已知的唯一在体内明确含有Chl d的生物体。
Chl d与Chl a的不同之处在于在叶绿素吡咯环第3位具有甲酰基而不是乙烯基,这种结构的变化导致色素的长波长吸收最大值红移约30 nm,从而加强了弱光(远红光)环境下的适应能力,促进光能自养生长。
与大多数蓝藻不同的是,A. marina含有Chl d结合的Pcb捕光蛋白,是由pcbA和pcbC编码,这些蛋白不同于高等植物和绿藻的膜内捕光天线。Pcb蛋白的分子量约为35 kDa,与PSII的内周捕光天线CP47和CP43以及某些蓝藻缺铁时诱导的IsiA蛋白在结构上同源。Pcb蛋白通常存在于缺乏藻胆蛋白的原绿藻中,其中结合Chl a和Chl b,并作为PSI和PSII的外周光捕获系统。而A. marina同时含有膜内的Pcb捕光蛋白和膜外的藻胆蛋白,它们都能为PSII捕获光能。但到目前为止,这种超级复合物整体的精细结构和Pcb蛋白亚基与PSII核心间的相互作用及复合物中色素间的能量传递路径都尚未被确定。同时,关于光系统II(PSII)利用远红光的分子机制仍不清楚。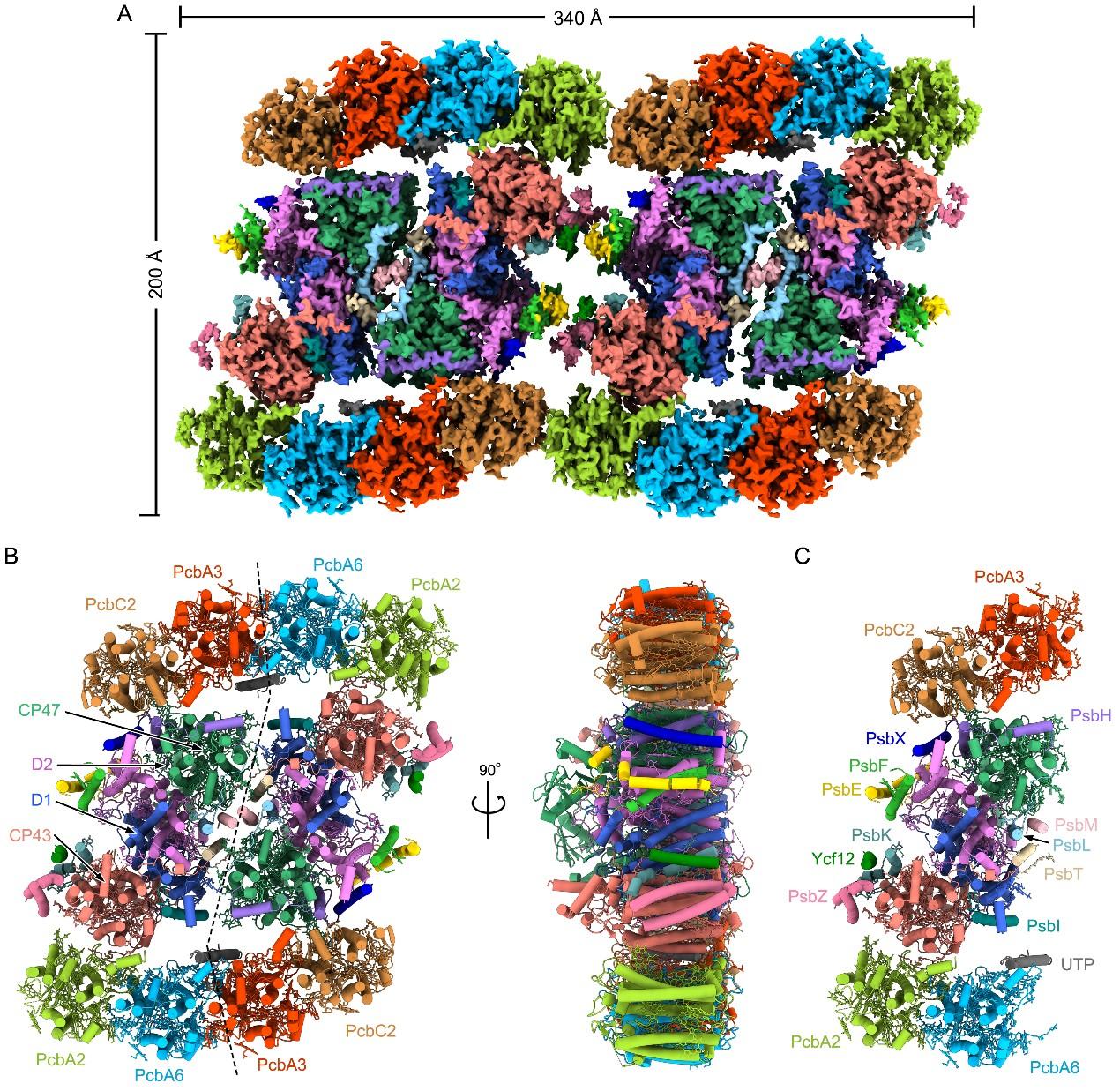
图1 A. marina PSII-Pcb四聚体超大光合膜蛋白复合体的整体结构
该超大复合体长、宽和高分别约为340 Å、200 Å和90 Å,由两个PSII核心二聚体及两侧16个对称的Pcb蛋白组成的,包含80个蛋白亚基和624个辅因子,总分子量约为1.9 Mda。每个PSII单体包含15个核心亚基和4个Pcb天线亚基(命名为PcbA2、PcbA6、PcbA3、PcbC2)。在这些Pcb亚基中,PcbA2和PcbA6直接结合到PSII核心的CP43侧,而PcbA3和PcbC2通过PsbH连接到CP47侧。基于复合体独特的结构特点及色素分子的排列情况,研究人员在这一复合体中发现了多条光能捕获及传递途径(图2)。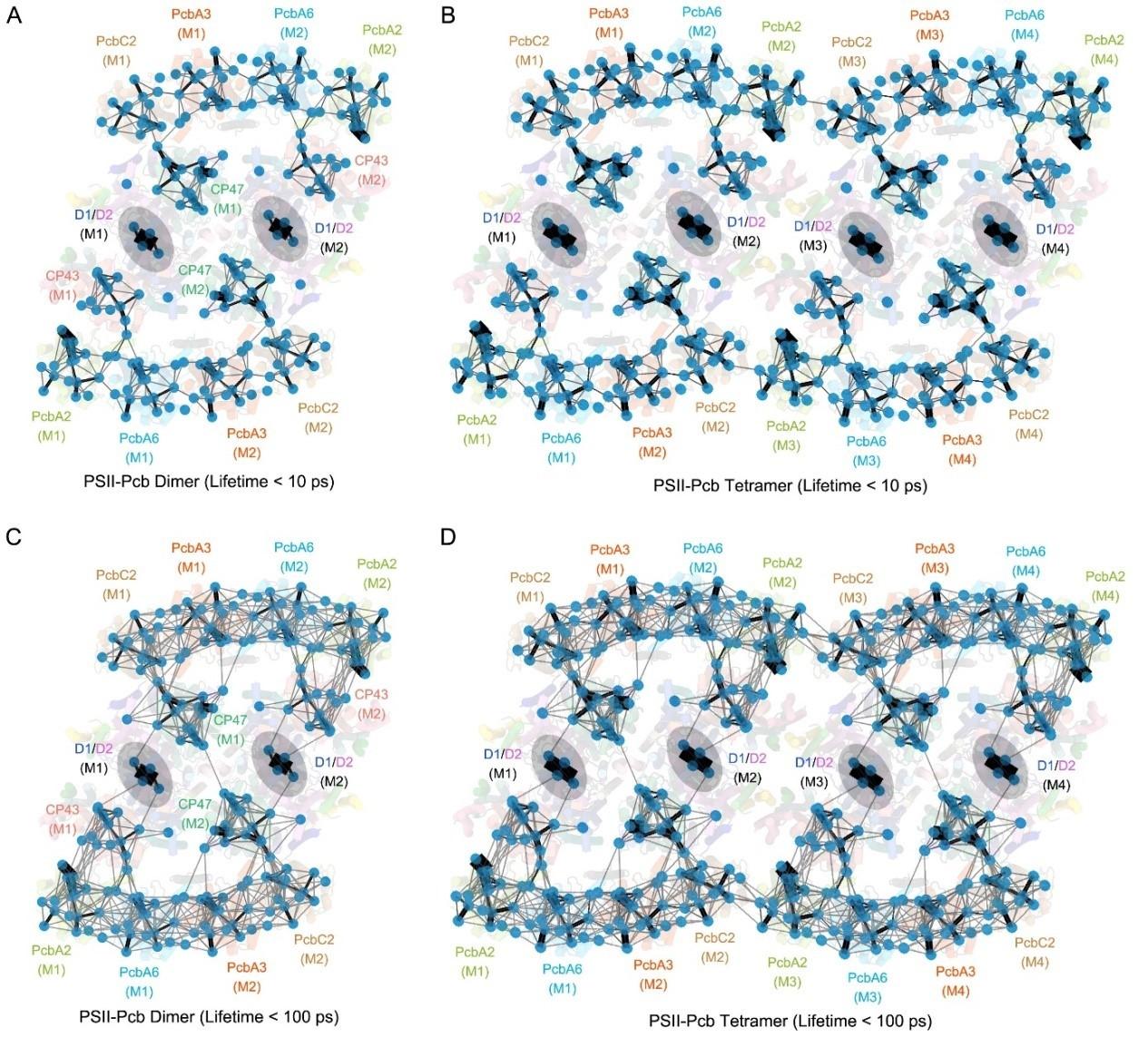
图2 A. marina中PSII-Pcb二聚体和四聚体的FRET网络
A. marina PSII-Pcb四聚体的一个独特特征是含有跨膜的Pcb蛋白并作为主要的捕光天线蛋白。迄今为止,仅在A. marina中发现了结合叶绿素d的Pcb蛋白。这是一种独特的光合色素蛋白复合体,而像Prochlorothrix和Acaryochloris thomasi(RCC1774)这样含叶绿素b的蓝藻中的Pcb蛋白可能也具有类似的结构,并可能使用类似的机制来适应外部光环境。每个PSII-Pcb单体包含4个Pcb蛋白,这增加了整体复合物的捕光天线截面积,并提高了A. marina中PSII的光捕获能力。高分辨的电子密度图使我们能够识别整个结构中所有Pcb亚基的类型,并得出PcbA型和PcbC型天线与PSII相结合。尽管有人认为PcbC可以在铁缺失下诱导并与PSI形成复合体,然而在PSII-Pcb结构中未观察到在铁缺失下诱导并与PSI形成复合体的IsiA蛋白。值得注意的是,所有这些Pcb亚基都包含六个跨膜螺旋,它们的N端和C端区域都位于基质侧,这与绿藻和高等植物中发现的典型LHC蛋白结构显著不同,后者具有三个跨膜螺旋。
通过对PcbA型和PcbC型天线在结构和色素排列方面进行比较,团队发现PcbA型天线的结构和色素排列与IsiA相似,而PcbC型天线展示了一些不同的结构和色素结合位点(图3)。此外,与其他生物的LHC天线不同,A. marina的Pcb天线包含多个Zea,类似于红藻PSI中的Lhcr天线,表明Pcb天线可能在A. marina的光保护过程中发挥着重要作用。总体而言,不同类型Pcb蛋白的存在及其特定的结构特征表明,Pcb天线对于PSII的超分子结构及A. marina对阴暗栖息地和富含远红光条件的光适应非常重要。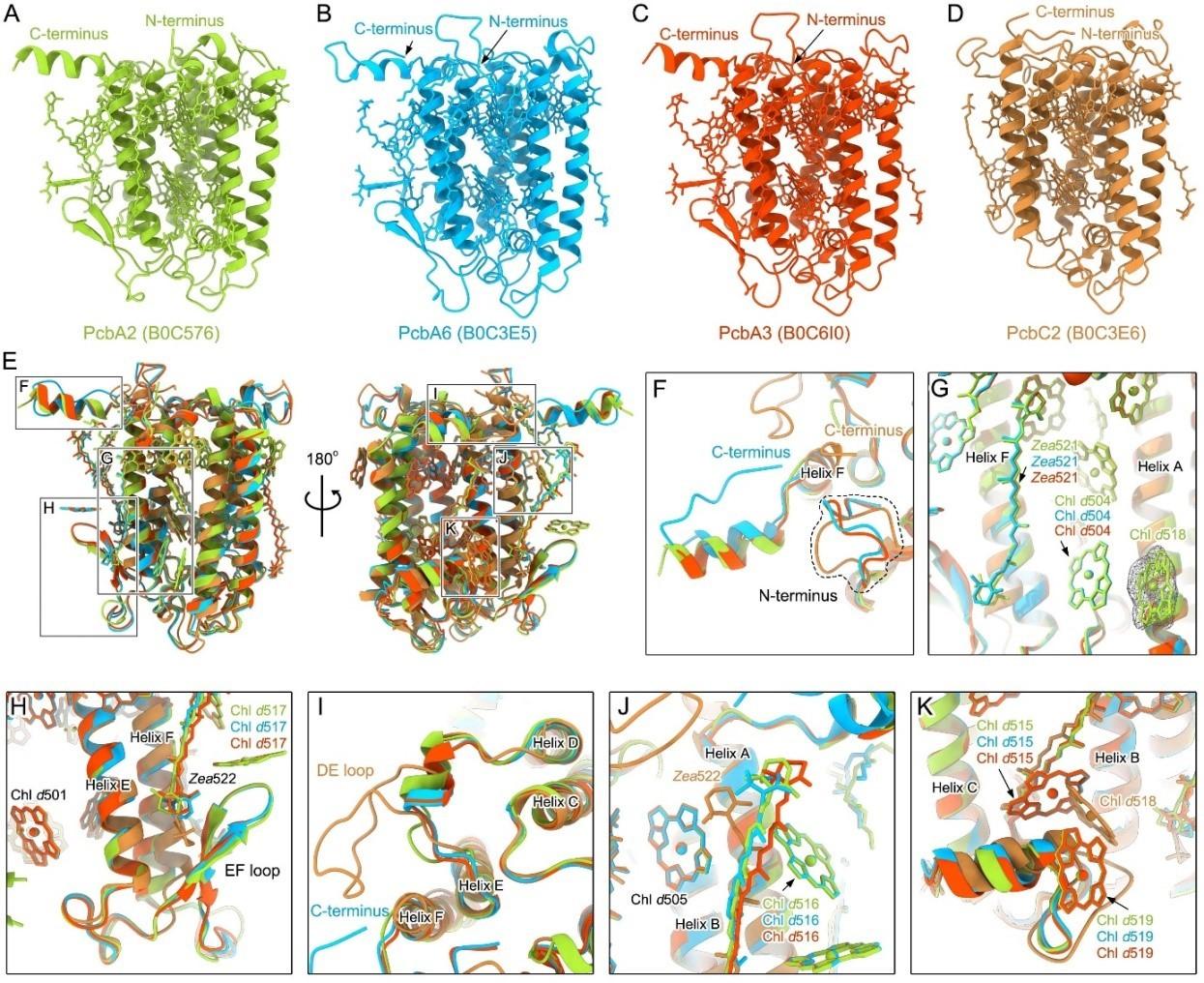
图3 A. marina中4种Pcb天线的结构
由于A. marina具有与绿藻和高等植物不同的独特Pcb排列,Pcb天线与PSII核心之间的组装将与绿藻和高等植物有所不同。在PSII-Pcb结构中,所有Pcb天线以单体形式存在,因此单体Pcb天线通过内在的捕光蛋白CP43和CP47直接与PSII核心结合。在CP43和CP47亚基中发现了新的叶绿素分子,可能有助于PSII核心与Pcb天线之间的连接,并实现Pcb与PSII核心之间的能量传递。在PSII-Pcb二聚体的天线界面发现了一种未知蛋白,它像钩子一样连接两个PSII单体中的Pcb天线,并确保PSII-Pcb四聚体中二聚体的稳定性。此外,在两个PSII二聚体的PSII核心和Pcb天线亚基之间也都发现了强烈的相互作用,这可能介导PSII-Pcb四聚体结构中两个PSII二聚体的结合。
图4 A. marina中PSII-Pcb四聚体中各亚基的相互作用
该研究成果打破了原有对光系统II复合体存在形式及光能利用机制的认识,为揭示Chl d型蓝藻利用远红光分子机制提供了结构基础,为理解光合生物光能利用和光适应机制的多样性提供了重要信息,研究成果将对设计新型宽光谱光能利用光合系统和高光效作物提供重要启示。
南方科技大学冷冻电镜中心博士后沈亮亮、工程师高远瞩和浙江大学博士研究生汤凯璐为论文共同第一作者,中国科学院植物研究所研究员韩广业、南方科技大学教授王培毅、浙江大学教授张兴为论文共同通讯作者。中国科学院植物研究所院士匡廷云、王文达研究员和澳大利亚悉尼大学教授陈敏等参与了该研究。南方科技大学为本文第一作者和通讯作者单位。该研究工作得到了国家重点研发计划、国家自然科学基金、中国科学院稳定支持基础研究领域青年团队计划、中国博士后科学基金、南方科技大学校长卓越博士后等项目资助。样本制备得到中科院植物所公共技术服务中心的支持,冷冻电镜数据收集和处理在南方科技大学冷冻电镜中心完成,浙江大学医学院冷冻电镜中心与蛋白质平台也为课题提供了技术支持。
文章链接:
https://www.science.org/doi/10.1126/sciadv.adk7140
供稿:冷冻电镜中心
通讯员:和思淼
编辑:曾昱雯




