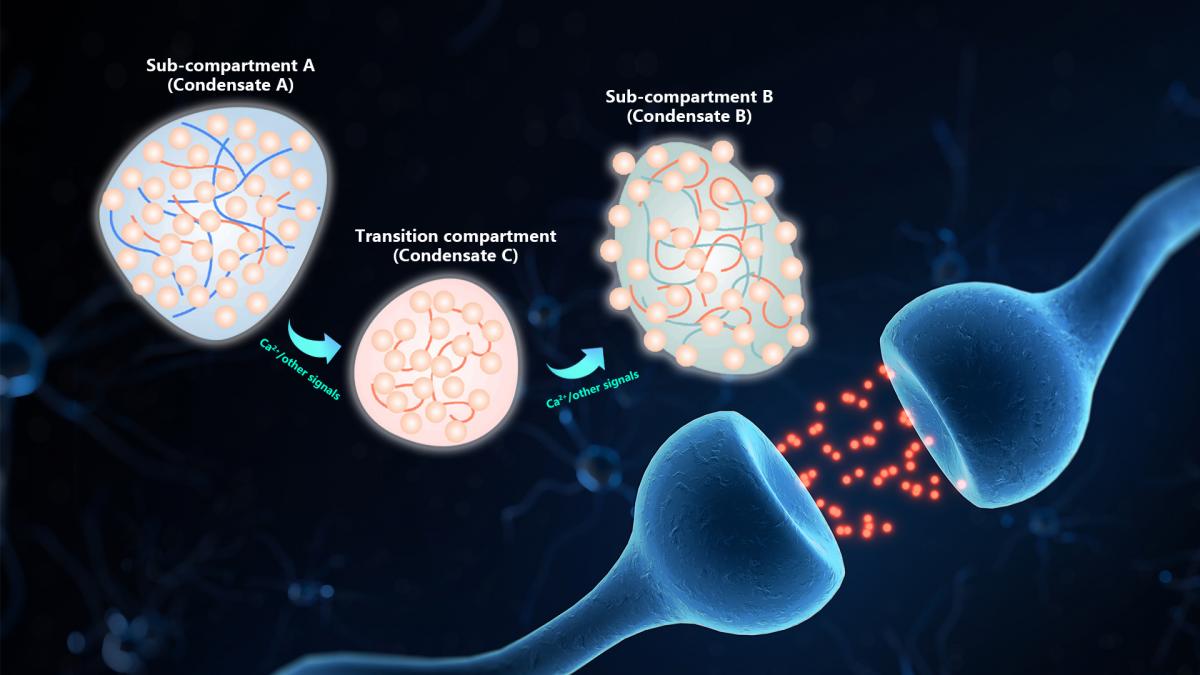
近日,中国科学院院士、南方科技大学生命科学学院院长张明杰团队,以突触前膜为模板,以突触小泡的运输为具体案例,深入揭示了由相分离机制介导、不依赖于马达蛋白与细胞骨架及零能耗的定向运输方式,为我们理解细胞内短距离定向运输提供了全新的视角。文章以“Short-distance vesicle transport via phase separation”为题,在顶级期刊Cell上在线发表。
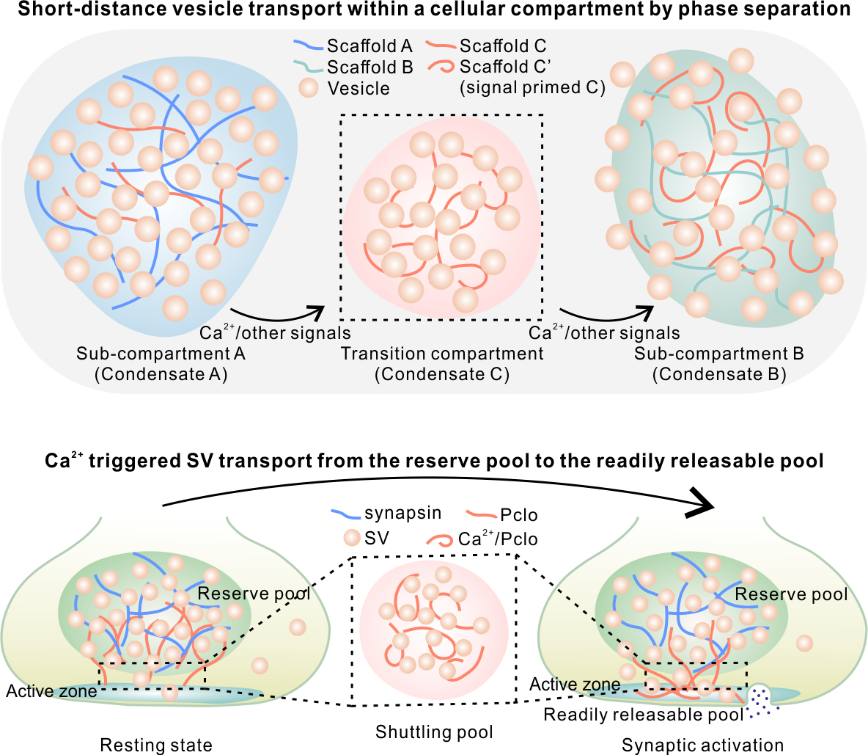
图1 相分离介导的短距离囊泡运输模式图
在细胞内,长距离的物质运输主要是通过马达蛋白牵引货物沿着细胞骨架进行定向移动来实现的。然而,细胞内同样存在着许多短距离定向运输的需求,例如突触前膜的突触小泡需要从储备区(reserve pool)调动至活性区(active zone),以及COPII和COPI囊泡在高尔基体潴泡间定向转运等。对于这类短距离运输,依赖于马达蛋白和细胞骨架的方式不仅能耗过大,而且通常这些短距离运输的场景并不涉及细胞骨架的参与。另一方面,被动扩散虽然能发生,但却无法满足方向性的运输需求。因此,细胞如何巧妙地应对这种短距离定向运输的挑战,是细胞生物学研究领域里悬而未决的问题。课题组研究表明,突触前膜内的短距离运输高度依赖于钙感应动态支架蛋白Pclo,其全长超过5000个氨基酸,展现出独特的细长拉伸形态,使其成为连接储备区与活性区的关键分子桥梁。

图2. Pclo在响应Ca2+刺激下将突触小泡从原来与synapsin共定位的状态中(A)提取出来(B),实现突触小泡从储备区的脱离
首先,研究团队发现Pclo能够被招募至由synapsin相分离介导所形成的储备区凝聚体中(图2A)。随后,在钙信号的刺激下,Pclo作为钙感应器发生构象变化,并与突触小泡发生相分离。这一转变使得Pclo能够成功从储备区提取突触小泡,进而形成Pclo/囊泡转运凝聚体(图2B)。

图3. Pclo与活性区蛋白直接相互作用(A),并因此被特异性富集到活性区凝聚体中(B)。Pclo可以显著增强囊泡在活性区表面的贴附效率(C-D) ,Ca2+刺激将进一步增强囊泡贴附(E)
另一方面,Pclo与ELKS、RIMBP等其他突触前膜活性区蛋白之间存在广泛的相互作用(图3A)。重要的是,Pclo能够被特异性地富集到由RIM, RIMBP, ELKS共同介导形成的活性区凝聚体中(图3B)。得益于Pclo的桥梁作用,从储备区中提取出的囊泡能够定向递送并吸附于活性区凝聚体表面(图3C-D)。值得一提的是,这一吸附效应在钙信号的刺激下会得到进一步增强(图3E)。为了验证这一机制的普适性,研究人员利用大鼠脑内纯化的真实突触小泡重复了上述实验,得到一致的结果。
综上所述,本研究揭示了一种新型的由相分离介导的囊泡运输方式,该方式既摆脱了传统远程运输对马达蛋白与细胞骨架的依赖,又解决了被动扩散无法提供方向性的问题。
张明杰课题组长期深耕于神经系统的结构与功能研究,近年来在神经突触里的相分离研究领域做出了一系列开创性成果。课题组于2019年在Molecular Cell首次提出了相分离介导突触前膜活性区形成这个概念(详见BioArt报道:Mol Cell | 张明杰组报道相分离对于重新认识突触的形成与维持的重要意义);随后于2021年在Molecular Cell探讨了相分离介导的突触小泡在活性区的定位机制(详见BioArt报道:Mol Cell | 张明杰组报道相分离介导突触小泡定位到突触前膜活性区的机制 );本文作为张明杰院士课题组在突触前膜相分离研究领域的第三部力作,继前两部研究的深厚积淀之上,进一步深入探索了钙信号刺激下,相分离机制如何介导突触小泡从储备区动态转移至活性区的精细过程。这一发现不仅丰富了我们对于突触前膜功能调控的理解,也为未来神经科学领域的研究提供了新的启示。
张明杰院士为本文的通讯作者,香港科技大学博士研究生裘骅和博士后吴先登为本文的共同第一作者。该研究与中国科学院生物物理研究所张宏院士、清华大学教授葛亮合作完成。生物物理所博士生马晓丽、清华大学博士生李树林、厦门大学教授蔡期湑,以及德国马普研究所Marcelo Ganzella博士对本文亦有贡献。该研究得到了国家自然科学基金委基础科学中心项目、广东省创新团队、深圳市高层次人才团队、深圳市基础研究重点专项等项目的支持。
文章链接:https://www.cell.com/cell/abstract/S0092-8674(24)00251-4
供稿:生命科学学院
通讯员:付文卿
主图:丘妍
编辑:任奕霏




