
2017年6月12日,南方科技大学生物系教授郭红卫研究组与北京大学肖俊宇研究组合作,在Nature Communications在线发表题为“Pyrazinamide and derivatives block ethylene biosynthesis by inhibiting ACC oxidase”的研究论文。
植物气体激素乙烯在植物生长发育和防御应答中发挥着重要作用,也参与调节果实成熟和器官衰老,对采后果蔬和花卉贮藏期间的生理活动及品质具有重要影响。大量产生的乙烯会缩短果蔬和花卉的保质期,引起其过早过快衰败,造成食品安全问题和巨大的采后损失(仅我国每年的果蔬采后损失可达数千亿元)。因此,开发特效而安全的乙烯反应抑制剂将具有巨大的经济效益和社会效益。
郭红卫研究组利用植物化学遗传学手段,以拟南芥乙烯过量合成突变体eto1-2和乙烯信号活化突变体ctr1-1为筛选材料,从2000种化学小分子文库中筛选出了3种可抑制乙烯合成或反应的小分子化合物:kynurenine(KYN),ponalrestat(PRT)和pyrazinamide(PZA)。他们早期的研究发现KYN能够抑制乙烯所诱导的下游生长素合成途径中的一类关键酶TAA1/TARs(He et al., 2011 Plant Cell),最近发现PRT也作用于乙烯下游反应,抑制了生长素合成途径中的另一类关键酶(相关工作正在整理发表中)。
不同于KYN和PRT,第三个小分子PZA只特异性抑制乙烯过量合成突变体eto1-2的“三重反应”(图A)。施加PZA处理可以抑制乙烯合成前体ACC所诱导的乙烯反应,暗示PZA可能通过抑制ACC氧化酶(ACC oxidase,ACO)而抑制乙烯合成。体外生化分析发现,PZA无法直接抑制ACO催化活性,需要被拟南芥烟酰胺酶(nicotinamidase)转化为pyrazinoic acid(POA)(图B),进而以POA的形式竞争性抑制ACO的催化活性。
郭红卫研究组与北京大学肖俊宇研究组合作,进一步解析了拟南芥中ACO家族成员ACO2与POA复合物的高分辨率晶体结构(2.1Å),从原子层面揭示了POA的抑制机理(图C和图D)。晶体结构表明,POA是通过与活性中心的一个锌离子或铁离子形成配位键而与ACO2结合。此外,POA与其周围氨基酸之间形成的氢键、疏水相互作用以及范德华力,也巩固了其与蛋白的结合。通过对ACO2蛋白关键氨基酸进行突变,证实了POA或其类似物2-PA可以模拟ACO的内源底物ACC,从而竞争性抑制了ACO的活性。这些结果不仅在原子层面上阐明了POA的抑制机理,还为进一步优化POA结构,提高其抑制活性提供了理论基础。
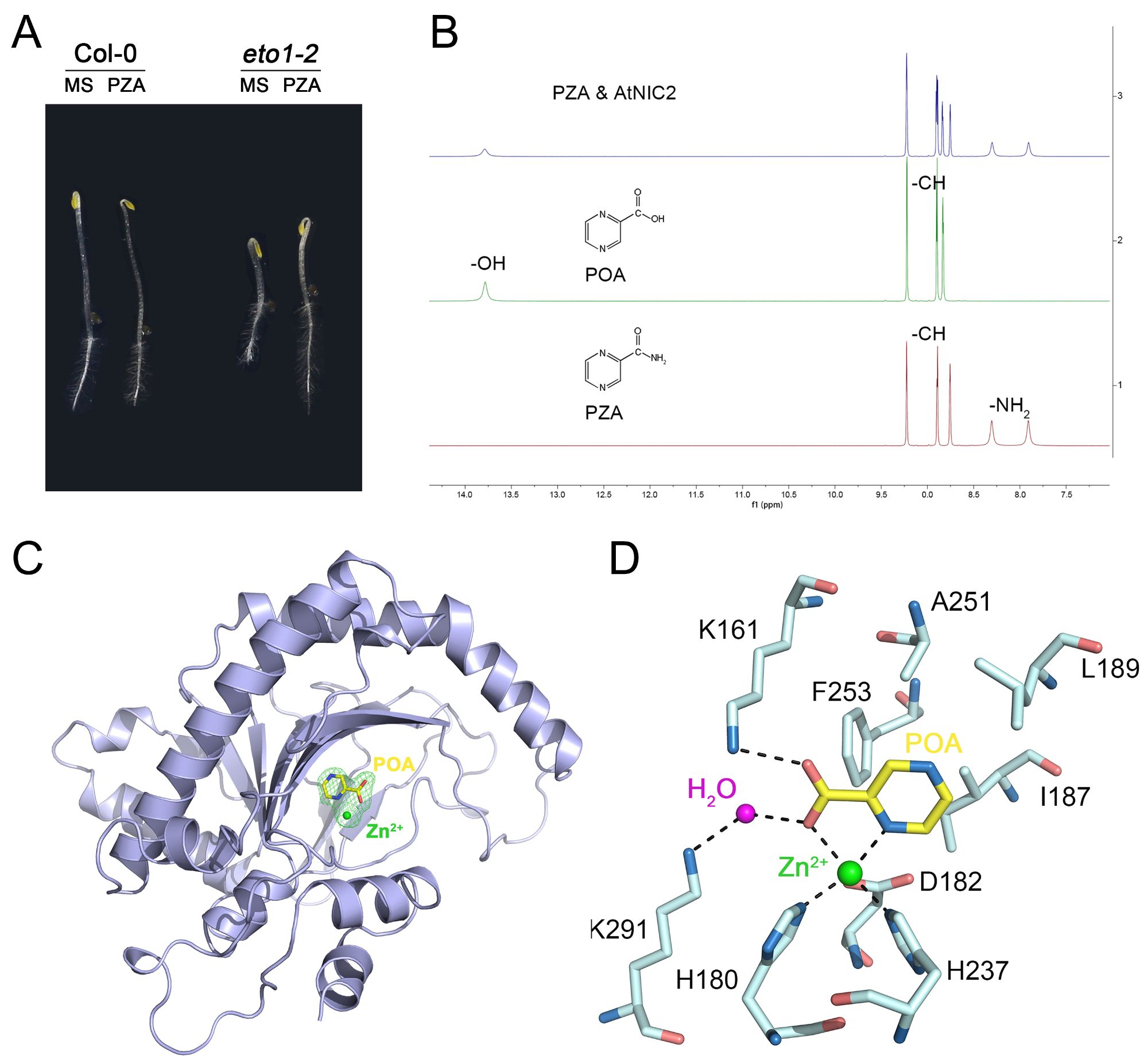
A. PZA特异性的抑制eto1-2的乙烯反应 B. PZA能被拟南芥NICs转化为POA C. POA与拟南芥ACO2蛋白复合体结构 D.POA与ACO2蛋白相互作用的分子细节
有意思的是,PZA是当前广泛使用的抗结核病(TB)的一线药物,在结核杆菌中它也需要转化为活性形式POA才能发挥抑菌作用。虽然其可能的作用靶标蛋白已有报道,但仍存在争议,所以其具体抗TB机制尚不清晰。本研究发现,在植物中POA通过结合ACO蛋白活性中心的Fe2+及特异氨基酸位点,进而抑制ACO催化活性。与之类似,在结核杆菌中,有报道称Fe和厌氧环境能够促进PZA的抑菌活性,暗示结核杆菌基因组中可能存在有类似ACO蛋白的氧化还原酶可能作为PZA的作用靶点。因此本研究首次在结核杆菌以外的物种中报道了PZA/POA的靶标,为其抗结核杆菌的作用机制研究提供了新的方向。
郭红卫研究组博士生孙祥忠和肖俊宇研究组李雅鑫为论文共同第一作者。郭红卫和肖俊宇是本文共同通讯作者。这项研究得到了南方科技大学、国家自然科学基金委员会(NSFC)以及北大-清华生命科学联合中心(CLS)的资助。
文章链接: https://www.nature.com/articles/ncomms15758
供稿:生物系




