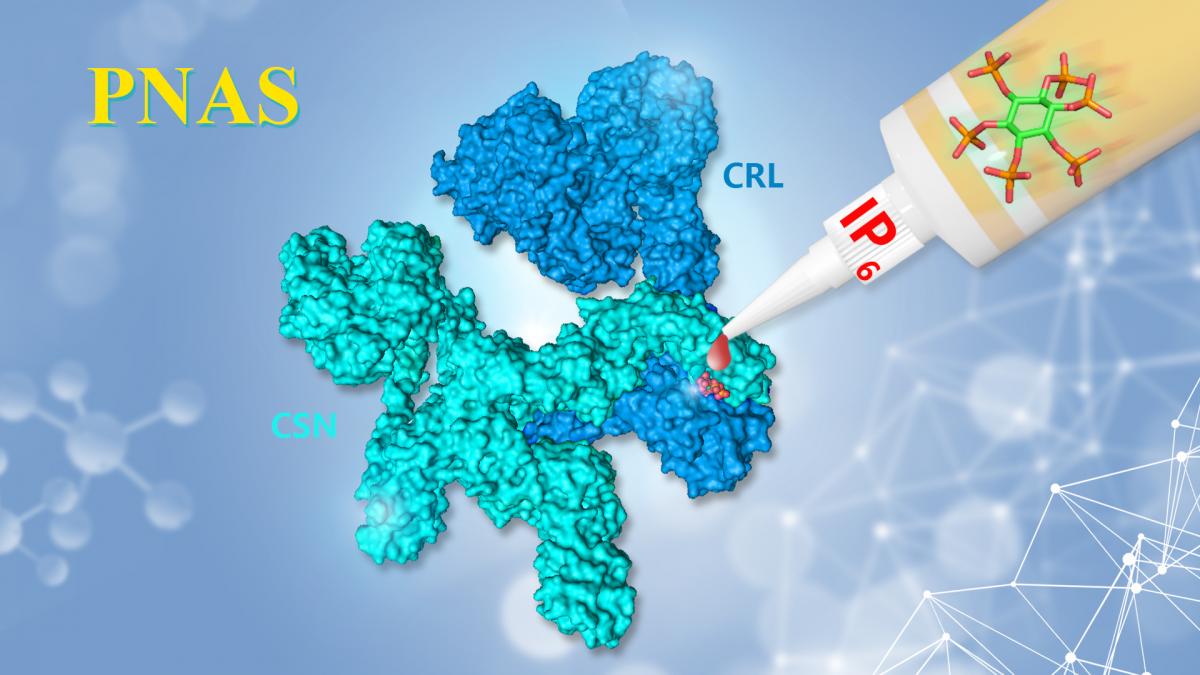
近日,南科大生物系副教授饶枫课题组与汪涛课题组(现深圳湾实验室)一项合作研究成果在《美国科学院院刊》(PNAS)在线发表。这项研究通过综合运用生物化学、结构生物学、化学生物学及遗传学等研究手段,揭示了代谢分子六磷酸肌醇(IP6)作为分子间“胶水”衔接泛素连接酶CRL和其抑制复合体CSN,从而调控CRL酶活性与蛋白质稳态的功能机制和进化保守性,为靶向CRL泛素连接酶明确了靶点。
文章发表后,PNAS 邀请了领域内国际专家发表特评,认为该论文阐明了一个领域里十几年一直未摸索清楚的问题 (见文末链接); Faculty of 1000资深教授专家库评价该论文认为具有特殊意义(special significance)而点评推荐(见文末链接)。
该项研究在饶枫课题组之前研究的基础之上,围绕CRL活性调控的系列研究成果。泛素化是一种细胞内的蛋白质“标记”系统,可以给不同的蛋白质打上不同的“标签”,使其更容易被准确识别并进行降解。当泛素化酶错误地“标记”了蛋白质,导致细胞死亡或衰老时,癌细胞就形成了。泛素化在蛋白质的定位、代谢、功能、调节和降解中都起着十分重要的作用,也参与了几乎一切生命活动的调控,与肿瘤、心血管等疾病的发病密切相关。因此,作为近年来生物化学研究的一个重大成果,它已然成为研究、开发新药物的重要靶点。
泛素-蛋白酶体系统是维持体内蛋白质稳态的核心“机器”,其中,E3泛素连接酶决定底物特异性。CRL泛素连接酶(Cullin RING E3 Ligases)是E3泛素连接酶中数量最多的一类,控制了总泛素化的20%,其家族成员在多种癌症中高表达或活性上调,参与了细胞周期、生长、代谢、存活、自噬、迁移和免疫逃逸等过程相关蛋白的异常降解,是潜在的肿瘤治疗热门靶点。CRL泛素连接酶受拟素化修饰(Neddylation)动态调控。COP9 Signalosome(CSN)特异催化CRL的去拟素化(deneddylation)。因此,CRL泛素连接酶的活性是由CRL-CSN复合物的组装和解离动态调控的,但CRL-CSN复合物的组装和解离机制还不是很清楚。
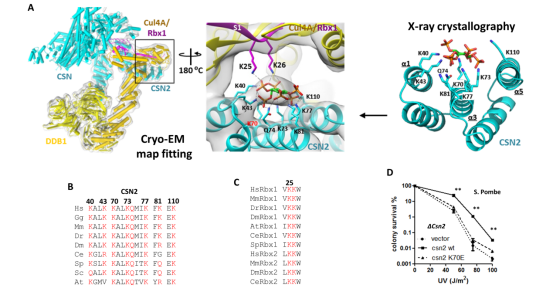
图1. IP6-CSN-CRL三元复合物的结构及自酵母到人类的进化保守性分析
为研究IP6如何调控CRL泛素连接酶,课题组首先使用多种生化手段证明IP6主要通过与CSN亚基2(CSN2)结合,并作为CSN的催化辅因子(catalytic cofactor)直接参与招募Cul4/Rbx1并加速Cullin去拟素化,是泛素连接酶CRL和去拟素酶CSN之间的分子“胶水”(图1B)。课题组进一步解析了IP6-CSN2复合物的高分辨率晶体结构(图1C),在CSN2蛋白里清晰的看到IP6小分子的电子云和结合模式,突变关键的结合位点,并进行了体内和体外验证。
为解析IP6如何同时招募Cul4/Rbx1, 课题组进一步利用所解析的高分辨率晶体结构对CRL4-CSN复合物的冷冻电镜结构进行装配(图1A),意外地发现了和IP6完美匹配的电子云,并鉴定出Rbx1上的K25/26残基和IP6直接相互作用。鉴于IP6的结合口袋由CSN2和Rbx1组成,Cul4不直接参与,课题组提出IP6是广谱的CRL-CSN分子间“胶水”的假设,并进行了体内和体外试验验证。这些结果阐明了IP6调控CRL-CSN复合体组装的机理,暗示IP6小分子的代谢是复合物解离的调控路径。

图2. 代谢小分子IP6动态调控CRL泛素连接酶去拟素化的示意图
IP6的结合“口袋”在进化上从酵母到植物到人都高度保守,说明了其重要性。课题组把CSN2-K70E突变敲入小鼠,发现会导致胚胎死亡。而在酵母里,CSN2-K70E突变体也无法回补Csn2敲除后酵母对紫外辐射不耐受的表型。这些结果说明IP6对CRL-CSN的调控进化上保守,功能上重要。最后,课题组还证明IP6能够保护CRL不被自泛素化降解,阐明了CRL泛素连接酶活性循环的最后一步的发生机理。
此项研究成果从分子水平阐释了IP6-CSN-CRL三元复合物的形成机制,并在CRL-CSN的作用界面发现了一个小分子结合“口袋”。鉴于CRL的拟素化抑制剂MLN4924已是治疗癌症的三期临床药物,本研究为靶向CRL的研究提供了新思路。
饶枫介绍,当前CRL泛素连接酶的研究多是聚焦在某个具体的泛素化底物上,像这样在整个CRL集群层面上探索蛋白质稳态调控的研究并不多。这项研究是始于2013年的持续探索,课题组一直走在世界前沿,早期受到过一些质疑,但在坚持不懈地努力下,最终发现了确凿的结构证据,无异议地证明了IP6小分子是调控CRL酶活的重要因子。课题组在后续的研究中还发现该调控机制的紊乱在肿瘤和糖尿病等重大疾病中起重要作用,是可行的干预靶点。

饶枫课题组合影(饶枫:第一排中;蔺红:第一排左二;张晓哲:第一排右二)
饶枫课题组研究学者蔺红、访问学生张晓哲与汪涛课题组博士后刘丽是论文的共同第一作者,饶枫与汪涛是论文的共同通讯作者,论文的其它作者还包括饶枫课题组博士后苏杨、徐志学,2017级南科大-东英吉利大学联培博士生何思宁,以及研究助理杨晓丽、魏夏云。南科大是该论文的第一单位和通讯单位。
本项研究得到了深圳市科创委,国家自然科学基金、国家重点研发计划、广东省自然科学基金和深圳市科创委的资助,以及霍华德休斯研究所教授郑宁,北京生命科学研究所研究员黄牛、杜立林,以及南开大学教授周传政等的帮助。
论文链接:https://www.pnas.org/content/early/2020/02/10/1911998117
Faculty of 1000推荐链接:https://doi.org/10.3410/f.737364180.793571437
PNAS特评链接:https://www.pnas.org/content/117/12/6292.long
供稿单位:生物系
编辑:刘馨
主图设计:丘妍




