近期,南方科技大学生物系兼职教授、美国科学院院士邓兴旺联合北京大学生命科学学院副研究员朱丹萌课题组,揭示了HY5(ELONGATED HYPOCOTYL 5)在光下可通过蛋白-蛋白直接互作增强BIN2 (BRASSINOSTEROID-INSENSITIVE 2)的激酶活性,抑制幼苗下胚轴伸长。相关论文以“Modulation of BIN2 kinase activity by HY5 controls hypocotyl elongation in the light”为题发表在《自然-通讯》(Nature Communications)上。
光是植物赖以生存的能量来源与关键生长发育信号。模式植物拟南芥幼苗在光下呈现短胚轴、子叶延展等典型特征。不论是外在的植物表型还是内在的分子机制方面的研究,都表明HY5是促进植物光形态建成的关键转录因子。科学界近二十年的研究工作构建了以HY5为中央枢纽的光信号转导网络,奠定了HY5作为转录因子的“明星”地位。
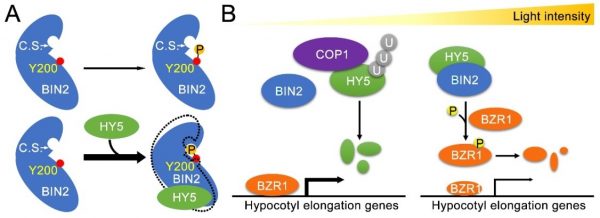
图1 光下HY5通过蛋白-蛋白相互作用增强BIN2的激酶活性抑制幼苗下胚轴伸长
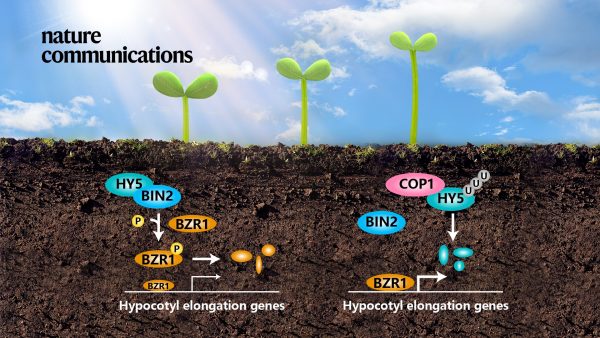
油菜素内酯(Brassinosteroid, BR)是一种能够促进细胞伸长的植物激素。BR信号通路中的关键负调控因子GSK3β蛋白激酶BIN2通过磷酸化转录因子BZR1 (BRASSINAZOLE-RESISTANT 1) 导致BZR1降解来抑制下胚轴伸长。已有研究显示,在HY5过表达株系内BZR1蛋白表达显著下降,但调控机制未知。邓兴旺团队发现,HY5在植物体内可通过与BIN2直接互作增强BIN2激酶活性,促进BZR1磷酸化及降解。随着环境光强增加,植物可通过增加HY5含量来调节BIN2激酶活性从而精确抑制下胚轴伸长。已有研究表明,BIN2第200位的酪氨酸(Y200)在动植物中保守,且其自磷酸化比例越高酶活越强。
此次研究发现,HY5可促进BIN2的Y200自磷酸化,同时确定HY5的亮氨酸拉链结构域是与BIN2互作并调节其激酶活性的关键所在。研究团队与中国人民大学副教授龚新奇合作开展了HY5与BIN2互作后的功能运动模拟,发现HY5结合BIN2后会促使BIN2改变其N端与C端相对运动方向,Y200更容易接近自身的激酶催化中心,从而增强其自磷酸化几率(计算机模型见图1A)。
综上,这项研究发现了HY5调控下胚轴伸长的新方式,揭示了其介导的BR信号抑制机理(图1B),为GSK3β激酶活性调控研究提供了新视角,或可为今后HY5蛋白的定向改造提供氨基酸位点信息。这项研究是研究团队继发现光形态建成抑制因子COP1抑制BIN2活性来促进暗形态建成的非经典功能 (Ling et al., 2017, PNAS)之后的又一新发现,并再次揭示光信号途径重要因子“技多不愁”的有趣现象。
谈到这个课题研究,南科大生物系研究助理教授李健的体会是要基于可信的实验结果大胆假设、小心论证。他介绍,“课题最开始筛到BIN2与HY5互作后,方向一直是分析BIN2对HY5的磷酸化作用,但是用了半年时间发现生化、遗传上的数据都不对,当时认为这个课题无法继续并搁置了半年。后面再回过头来看,发现遗传数据指示的是HY5在上游、BIN2在下游,所以大胆地推测HY5调控了BIN2。”
李健为论文第一作者,邓兴旺、朱丹萌以及龚新奇为论文共同通讯作者。南科大是论文第二通讯单位。该研究得到南方科技大学、科技部国家重点研发计划蛋白质重点专项、国家自然科学基金委、蛋白质与植物基因研究国家重点实验室,以及北大-清华生命科学联合中心的资助。
文章链接:https://www.nature.com/articles/s41467-020-15394-7
供稿:生物系
通讯员:李健 付文卿
编辑:苗雪宁




