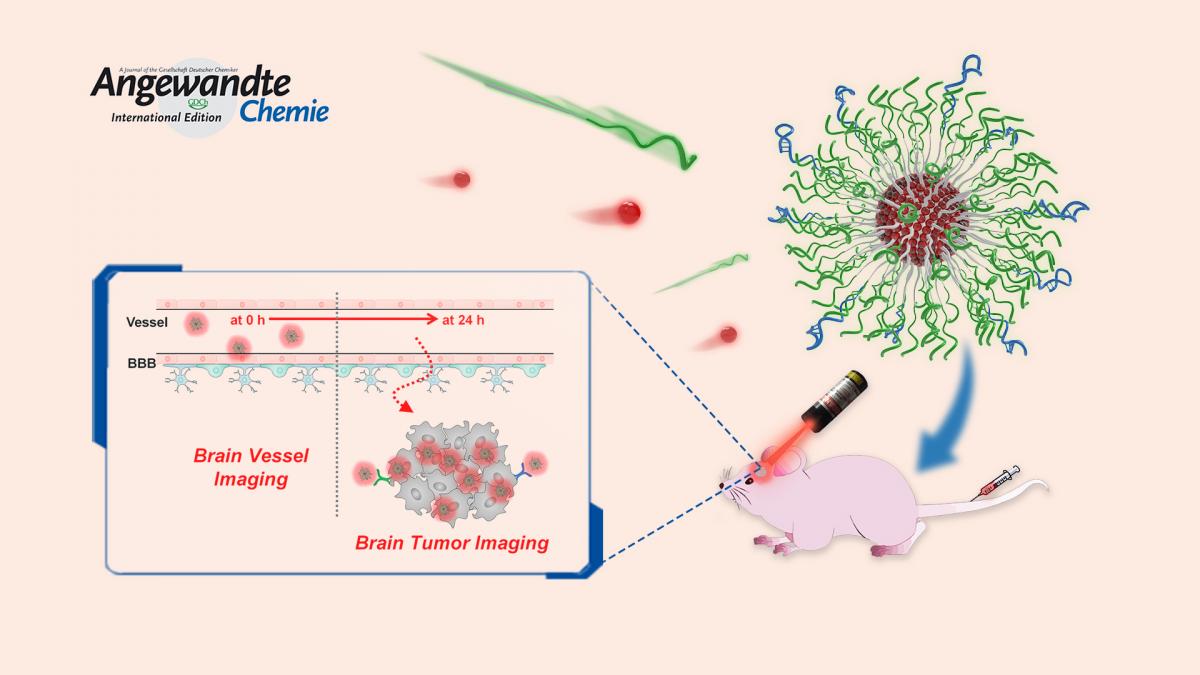
南科大材料科学与工程系(下简称“材料系”)副教授田雷蕾课题组从研究核酸的高分子特性以及化学改性方法入手,成功研究出若干有实际应用价值的新型生物医用核酸材料,近期相关进展在《德国应用化学》(Angewandte Chemie International Edition)和中国化学会旗舰期刊CCS Chemistry上发表。相关研究成果拓展了功能核酸在脑瘤成像、肿瘤微环境响应的药物富集、“自递送、自保护”核酸纳米药物等方面的应用。
癌症的早期诊断和靶向性治疗一直是最重要的科学问题之一。近年来,生物相容、能根据递送环境的变化做出智能响应、特异性靶向病变组织的纳米药物的相关研究受到了广泛关注。功能核酸分子具有分子识别能力广泛、可基因调控和编辑、生物相容、可程序化自组装等优点,是制备靶向和响应性的智能纳米药物的理想构筑单元。但是功能核酸也存在着如生物环境稳定性差、血液循环时间短、可诱发免疫原性、细胞通透性低等问题,限制了其在活体诊疗中的应用。
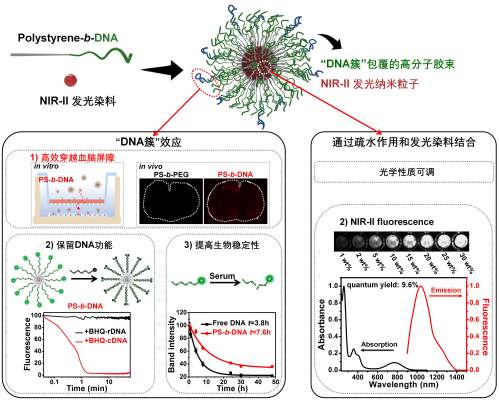
图1. DNA双亲嵌段聚合物组装成球形胶束,通过紧密堆积增加核酸的生物稳定性和细胞递送能力;疏水内腔可以用于增加新的功能,比如引入NIR-II发光分子。
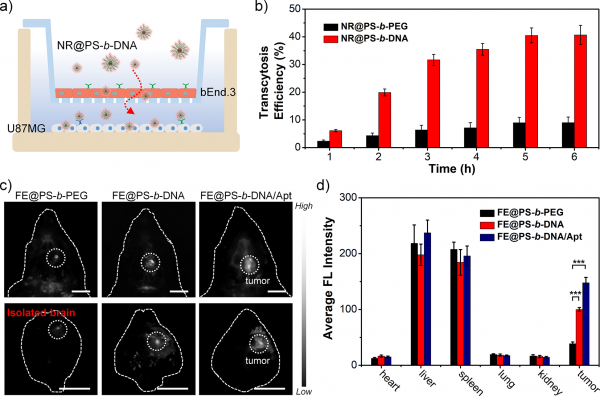
图2. (a) 体外血脑屏障模型的示意图;(b) 不同样品随时间变化的穿越模拟血脑屏障的效率,“NR”是疏水染料尼罗红;(c) 小鼠脑和离体脑组织用不同样品处理的NIR-II荧光图片;(d) 小鼠离体器官的荧光强度定量分析:“Apt”是靶向脑肿瘤细胞的适配体,通过杂交引入到PS-b-DNA纳米荧光团表面。
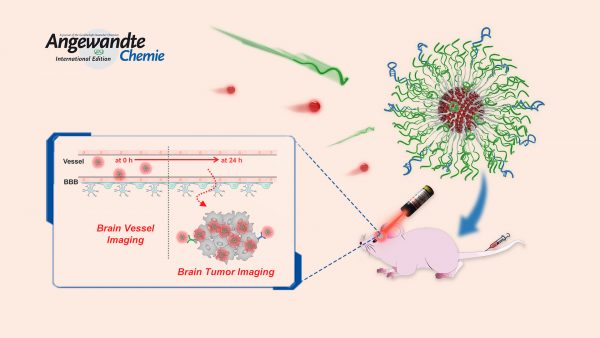
团队发表在《德国应用化学》的论文以“有机球形核酸助力近红外II区染料穿越血脑屏障(Organic Spherical Nucleic Acids for the Transport of a NIR‐II‐Emitting Dye Across the Blood–Brain Barrier)”为题,介绍了将DNA纳米技术应用于有机纳米材料开发的相关工作。在这项工作中,研究团队制备了一种可高效穿越血脑屏障及靶向脑瘤的NIR-II有机纳米粒子,实现了超高分辨率的脑瘤成像效果(图1)。
团队通过化学方法将DNA和疏水的聚苯乙烯高分子(PS)共价接枝合成双亲嵌段聚合物PS-b-DNA,这种DNA双亲嵌段聚合物除了可以作为纳米载体有效包覆强疏水的NIR-II染料外,其优势还在于纳米粒子表面紧密排布的DNA显示出“簇效应”。“簇效应”的存在不仅能提高DNA生物稳定性,还能增强纳米粒子与细胞表面清道夫受体的相互作用,帮助纳米粒子通过受体介导的转胞吞途径高效穿越血脑屏障。这一特性使PS-b-DNA相较于常用的PS-b-PEG载体在用于制备脑瘤成像的诊疗纳米粒子方面具有绝对优势。活体实验证明,在包载同样NIR-II染料的情况下,基于PS-b-DNA的纳米粒子在脑瘤成像时形成的荧光信号强度是基于PS-b-PEG的纳米粒子的3.8倍,可实现更精确的脑瘤诊断及定位(图2)。由此可见,结合DNA纳米技术可为开发具有更好脑瘤诊断和治疗效果的NIR-II有机纳米粒子提供一种全新的思路和方法。
南方科技大学-哈尔滨工业大学2017级联合培养博士生肖凡为本文第一作者,田雷蕾为唯一通讯作者,南方科技大学为第一单位和唯一通讯单位。此外,南方科技大学材料系教授梁永晔、医学院副教授刘泉、医学院访问学生林琳也对该文有重要贡献。
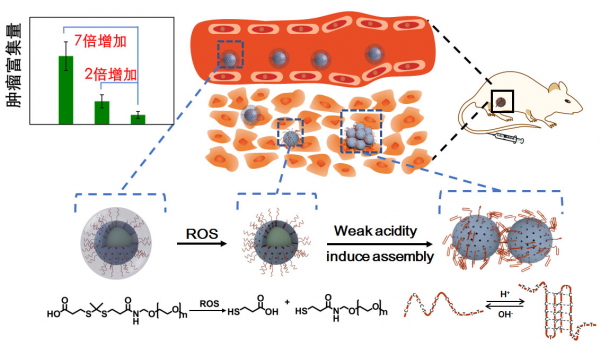
图3. 高分子复合接枝保护功能核酸,同时肿瘤标记物激活核酸功能,可极大提高核酸在肿瘤治疗中的功能发挥。
发表在《CCS Chemistry》的论文以“肿瘤微环境激活的DNA交联促进纳米粒子肿瘤富集(Robust and Tumor-Environment-Activated DNA Crosslinker Driving Nanoparticle Accumulation for Enhanced Therapeutics)”为题,介绍了利用复合接枝刺激响应性高分子提高功能核酸在血液循环过程中的稳定性,并通过刺激响应性设计在肿瘤部位原位激活核酸功能的相关工作(图3)。实体瘤的高通透性和滞留效应(EPR效应)是纳米药物发展的一个重要前提,但EPR效应在很多情况下对药物的富集效果并不明显。因此,通过对纳米药物的设计,在肿瘤部位实现微环境刺激诱发下的聚集组装成为目前提高药物富集的有效手段。核酸具有出众的分子识别和组装能力,但由于核酸在生物环境中的不稳定性,单纯使用交联DNA诱导诊疗纳米粒子聚集,只能达到2倍提升的富集效果。面对这一问题,研究团队研究出复合化学接枝方法,利用对活性氧(ROS)响应的TK-PEG高分子对交联DNA形成“临时”保护层。血液循环过程中PEG分子层可以保护DNA免受降解,增长血周循环时间。到达肿瘤部位后,ROS浓度升高,PEG分子被切断脱去,激活交联DNA识别微酸环境引发纳米药物在肿瘤部位原位聚集。田雷蕾介绍,通过复合使用交联DNA和ROS响应PEG,纳米药物在肿瘤部位的富集可以提升7倍,这在现有的组装提高富集的研究中是较为突出的结果;将这一策略应用于CuS光热治疗纳米粒子,可促进肿瘤区间的光热转换温度从50.2 ℃提高到56.5 ℃,抑瘤效果可提高13倍。
南方科技大学材料系科研助理巢志聪为本文第一作者,田雷蕾为唯一通讯作者,南方科技大学为该论文第一单位和唯一通讯单位。相关研究得到了国自然基金、深圳市基础研究计划、深圳市孔雀团队项目、广东省创新创业团队项目的支持。
《德国应用化学》论文链接:https://doi.org/10.1002/anie.202002312
CCS Chemistry论文链接:https://doi.org/10.31635/ccschem.020.202000134
供稿单位:材料科学与工程系
通讯员:周斌
编辑:吴一敏
主图设计:丘妍




