
2020年9月22日,南方科技大学生物系、冷冻电镜中心研究教授王培毅团队,联合中科院微生物研究所、武汉病毒所、山西高等创新研究院以及中国国际医药卫生有限公司等单位,在国际著名期刊Nature Communications上发表题为 “Cryo-EM structure of the varicella-zoster virus A-capsid ”的研究论文,利用冷冻电镜技术解析了VZV病毒衣壳3.7 Å分辨率的精细三维结构,并分析了病毒组装的分子机制以及潜在的抗病毒靶点,为研发特异或广谱的抗疱疹病毒药物提供重要依据。

水痘-带状疱疹病毒(Varicella-zoster virus,VZV)俗称“缠腰蛇”,广泛存在于自然界中。人感染后皮肤表面会出现成群的红斑水疱,严重时会发生坏死溃疡,并能引发诸如肺炎、脑炎和一些免疫系统疾病,导致全球每年约3万人死亡,大多数为儿童患者。VZV具有独特的潜伏再激活机制,感染后病毒长期潜伏于脊髓神经元内,在一定条件下,会恢复活性重新增殖,使得感染引发的疾病很难痊愈,患者也会终生携带病毒。
VZV属于α疱疹病毒家族,是直径为150~200 nm 的双链DNA囊膜病毒。从外到内分别由表面囊膜、蛋白质中间层、衣壳及基因组四层组成。疱疹病毒衣壳结构极为复杂,直径是寨卡病毒(ZIKV)的2.5倍,甲肝病毒(HAV)的4倍,内含上千个蛋白亚基,是结构生物学领域的难点之一。其直径约为125 nm,具有多种组装状态,至少包括A、B、C三种类型,均为非标准正二十面体。A型内部不包含其他蛋白及病毒基因组,B型内部包含支架蛋白,C型内部包含病毒基因组。衣壳不仅能保护基因组,而且在病毒组装、成熟、侵染过程中发挥关键作用。
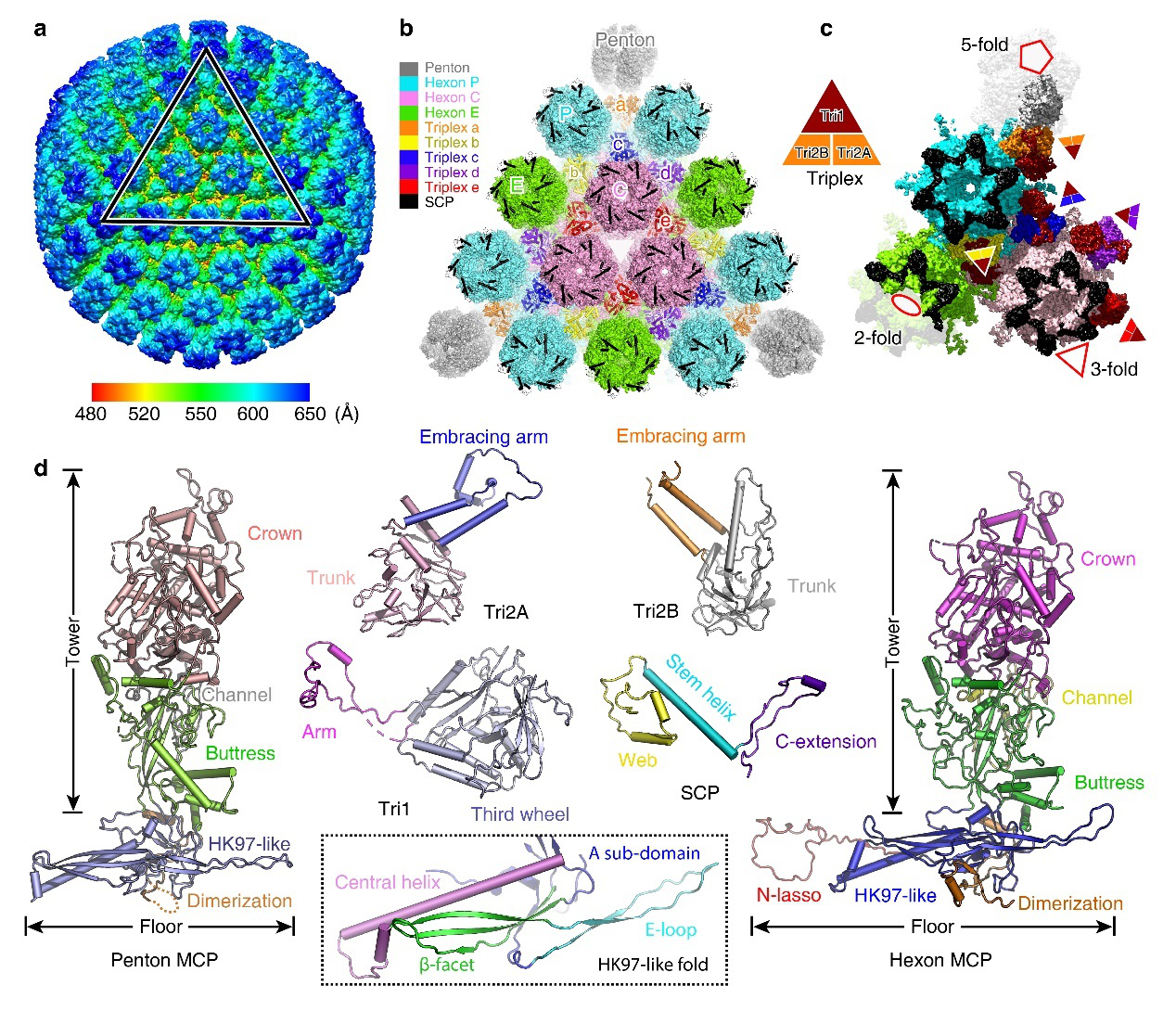
图1 水痘-带状疱疹病毒(vzv) A型衣壳整体结构
VZV衣壳主要包括四种蛋白成分,分别为主要衣壳蛋白(MCP)、次要衣壳蛋白(SCP),以及构成异源三聚体的Tri1和Tri2蛋白。各种蛋白组分按照T=16的二十面体对称进行排列, 每个不对称单位(ASU)包含16个MCP, 15个SCP和5 组异源三聚体(Ta-Te)。MCP聚集形成五邻体(Penton)和六邻体(Hexon),分别位于五次轴顶点和二十面体平面上。根据Hexon位置不同分为peripentonal (P), edge (E), 和 center (C) 三种类型。Penton中五个MCP拷贝间隙较大,因而稳定性相对较低;而Hexon中六个MCP间组成更加紧密,并且有顶部的六个SCP蛋白螺旋覆盖其上,C端延申到SCP-MCP间隙,增加其稳定性。与其他已知人类疱疹病毒结构相比,VZV衣壳在Penton和P-Hexon界面上结构稳定性低于其他病毒衣壳,这可能与其基因组较小有关,因而衣壳所承受的压力相对较小。这一发现与同期发表的其它课题组结果相一致。
通过比较不同α、β、γ三组疱疹病毒结构,研究人员发现SCP的C末端和Tri1亚基的局部结构在不同家族的疱疹病毒中具有明显多样性。α疱疹病毒SCP-N端包含两个小螺旋和一个大环结构,而β疱疹病毒和γ疱疹病毒SCP-N端则折叠更有序,拥有更长的螺旋结构。最显著的区别是SCP-C端,在α疱疹病毒SCP-C端包含一个发夹环,该环将相邻的MCP交联,增加Hexon稳定性。γ疱疹病毒KSHV的SCP-C端形成一个小的桥接螺旋,与相邻的SCP蛋白接触,而β病毒中相应的SCP区域在结构上较为无序。SCP的中央茎螺旋与MCP顶部的结合方向在α 疱疹病毒和其他两种疱疹病毒亚家族截然不同。VZV、HSV-1 和 HSV-2 SCP 中的螺旋相对于基底层明显倾斜,而在 KSHV、HCMV 和 HHV-6B 的结构中,螺旋具有较小的倾斜角,从而适应不同的C端结构,以稳定 Hexon 结构。VZV SCP有独特的长C端尾巴,γ疱疹病毒的SCP中也有类似的柔性C端,但KSHV比VZV短。先前研究表明,VZV SCP的C末端包含独特的核定位信号,对于MCP-SCP入核转运至关重要。结构表明,该区域具有高度的灵活性,完全暴露在表面,从而能够保证蛋白转运与衣壳组装同时高效进行2。对于α疱疹病毒,Tri 1包含一个内部插入臂,与Tri 2A和Tri 2B的拥抱臂之间的凹槽结合。然而β疱疹病毒和γ疱疹病毒中的Tri1缺乏插入臂结构来帮助异源聚体组装。因此,SCP和Tri 1可作为潜在的特异性抗病毒药物靶点, 通过干扰病毒蛋白转运以及不同亚基间的相互作用来抑制衣壳组装。有研究报道,一种吡唑衍生物35B2能够与VZV衣壳蛋白结合来阻断病毒衣壳组装3。基于此结构和逃逸突变位点分析,研究人员发现在MCP底座下方有一个“口袋”结构可能是35B2的结合位点。该“口袋”也暗示着一个潜在的特异性抗VZV药物靶点。
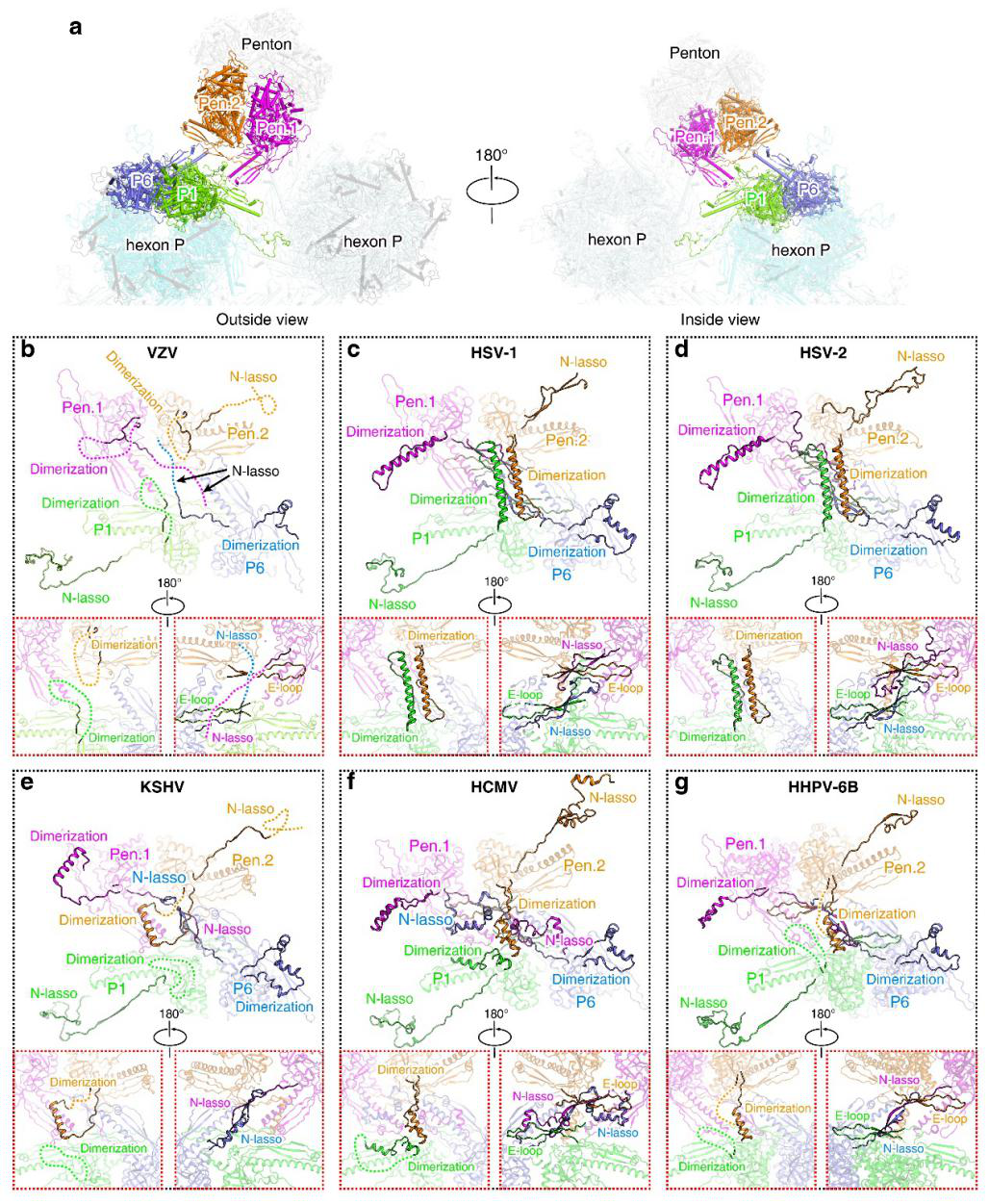
图2 比较不同疱疹病毒衣壳组装的相互作用界面
南科大为论文第一单位。王培毅,中科院微生物所研究员齐建勋,中科院武汉病毒所研究员罗敏华,中国国际医药卫生有限公司杨晓明教授为本文共同通讯作者。山西高等创新研究院孙俊清,南方科技大学冷冻电镜中心博士后刘聪聪,中科院微生物所助理研究员彭如超,长春祈健生物制品有限公司张夫坤博士和中科院微生物所副研究员仝舟为本文共同第一作者。中科院微生物所刘升博士、赵振楠博士等也参与了相关工作。
原文链接:https://www.nature.com/articles/s41467-020-18537-y
参考文献
1.Wang, W., Zheng, Q., Pan, D. et al. Near-atomic cryo-electron microscopy structures of varicella-zoster virus capsids. Nat Microbiol (2020). https://doi.org/10.1038/s41564-020-0785-y
2. Chaudhuri, V., Sommer, M., Rajamani, J., Zerboni, L. & Arvin, A.M. Functions of Varicella-zoster virus ORF23 capsid protein in viral replication and the pathogenesis of skin infection. J. Virol. 82, 10231-46 (2008).
3. Inoue, N. et al. Identification of a varicella-zoster virus replication inhibitor that blocks capsid assembly by interacting with the floor domain of the major capsid protein. J. Virol. 86, 12198-12207 (2012).
文字、图片:王培毅
供稿单位:生物系、冷冻电镜中心
通讯员:吴芳、付文卿
编辑:程雯璟




