近日,南方科技大学生命科学学院生物系副教授龚欣课题组在Nature Structural & Molecular Biology杂志在线发表了题为“Structural insights into the assembly and substrate selectivity of human SPT-ORMDL3”的研究成果,首次报道了鞘脂合成第一步也是整个鞘脂合成过程限速步骤的关键酶——人源丝氨酸棕榈酰转移酶SPT及SPT-ORMDL3复合物的三维结构,揭示了复合物详细的分子结构和各亚基之间组装的分子机制,同时还报道了SPT-ORMDL3与底物的复合物结构,通过广泛的突变位点研究,揭示了底物结合和选择性的分子机理。同期杂志在 News & Views 专栏对本文进行了点评。
鞘脂是一类非常重要的脂质小分子,它们不仅是生物膜系统的重要组成成分,同时还是非常重要的信号分子,参与了多种重要的生命活动。细胞内鞘脂的代谢失调,可能会导致癌症、心血管、神经退行性和免疫性等疾病的发生。真核生物所有鞘脂合成的第一步,也是整个过程的限速步,是由内质网膜上的SPT异源三聚体复合物所催化的,SPT可以催化将丝氨酸和棕榈酰辅酶A缩合形成鞘脂的合成前体3-KDS。人源SPT催化亚基SPLLC1和SPTLC2的基因突变会导致一种远端肢体感觉缺失的遗传性感觉和自主神经疾病HSAN1。SPT复合物具有一个分子量较小的调节亚基SPTssa或者SPTssb,该小亚基不仅能够大大激活SPT的催化活性,还能决定SPT催化过程中酰基辅酶A底物的选择性,但是小亚基发挥这些功能具体的分子基础都是未知的。ORMDLs蛋白是SPT复合物的关键调控因子,可以和SPT形成稳定的复合物并参与调控SPT的活性,从而调控细胞内鞘脂的稳态。人源ORMDL3基因与儿童哮喘的易感性密切相关。尽管SPT-ORMDL复合物在鞘脂的生物合成、稳态调控以及多种病理生理过程中都起着至关重要的作用,但此前对于SPT-ORMDL复合物的分子结构和体外酶催化特征还缺乏相应的研究。
该研究首先通过体外重组表达、纯化的方法获得了人源SPT和SPT-ORMDL3复合物的蛋白,并首次测得了复合物在体外的催化活性和相应的酶动力学参数。随后,利用单颗粒冷冻电镜技术,成功解析了人源SPT和SPT-ORMDL3复合物的高分辨率三维结构,其中SPT-ORMDL3复合物的三维结构如图1所示。结构显示SPTLC1和SPTLC2亚基在异源二聚体的基础上进一步形成了二聚体,然后每个SPTLC1-SPTLC2异源二聚体又分别和一个SPTssa亚基组成一个基本的异源三聚体催化活性单位。此外,每个SPT异源三聚体的中心都结合有一个ORMDL3分子,ORMDL3起到了稳定SPT复合物跨膜区的作用,当不存在ORMDL3时,SPT复合物跨膜区的柔性大大增强,但是目前对于ORMDL3是如何调控SPT活性的分子机制还有待进一步研究。
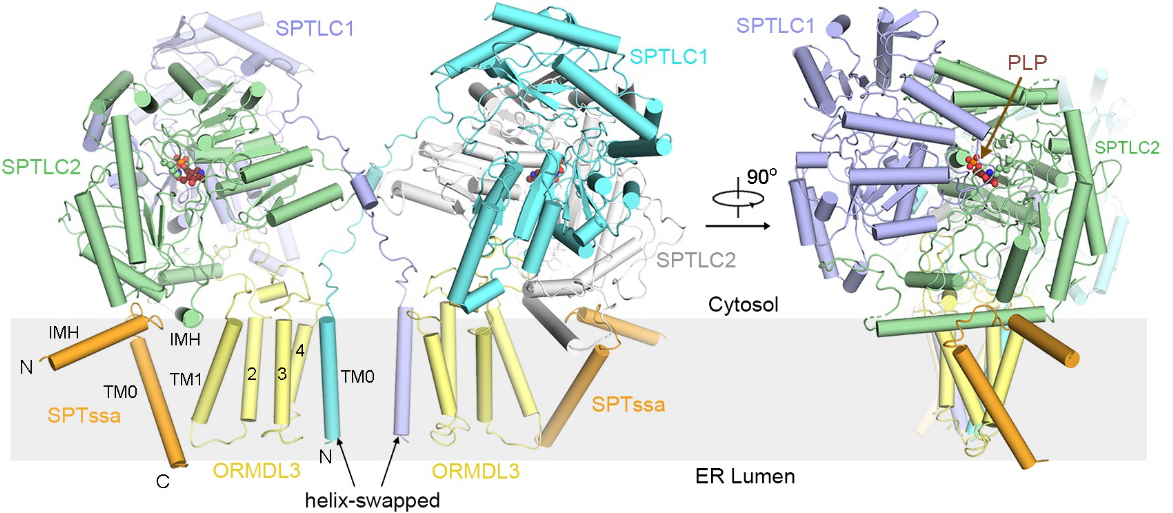
图1. 二聚化SPT-ORMDL3复合物的整体结构
该研究还进一步解析了SPT-ORMDL3复合物同时结合丝氨酸和棕榈酰辅酶A类似物的高分辨率冷冻电镜结构,并通过生化手段对底物结合位点进行了验证(图2)。结构显示SPTssa调节亚基中的疏水氨基酸Met28直接参与了酰基辅酶A底物中疏水酰基链的识别,当将Met28突变成带电氨基酸Lys时,SPT的活性大大降低,从而解释了SPTssa调节亚基对SPT活性的激活作用(图2f)。该结构揭示了SPTssa中Met28的独特结构定位,Met28的疏水侧链类似于一个疏水的塞子,伸入到SPTLC2的酰基结合口袋中,并刚好堵在疏水酰基链的尾部(图3a),因此Met28直接决定了酰基结合口袋的长度。与此相一致的是,当用较小侧链的氨基酸Val或者Gly取代Met28时,这两个突变体SPT-ORMDL3复合物对于具有更长酰基链的硬脂酰辅酶A的催化活性显著增加(图3b)。尽管仍有许多问题有待进一步研究,但该研究中的高分辨率结构信息为了解鞘脂稳态调控的机制提供了新起点,并为以后的研究和药物发现提供了重要的分子基础。

图2. SPT-ORMDL3复合物与两个底物结合的结构及生化验证
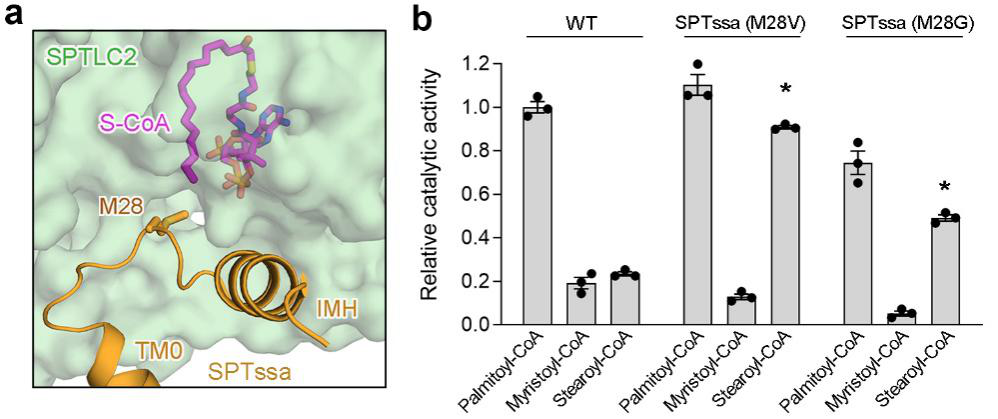
图3. 酰基辅酶A底物的选择性
南方科技大学生物系为该论文的唯一单位,龚欣为该论文的唯一通讯作者,课题组研究副教授李思思、研究副教授谢田、2019级硕士研究生刘鹏为本论文的共同第一作者。该研究得到了国家自然科学基金重大研究计划、广东省杰出青年基金等项目的资助,并得到了南方科技大学冷冻电镜中心的大力支持。
论文链接:https://www.nature.com/articles/s41594-020-00553-7
News & Views专栏评论性文章: https://www.nature.com/articles/s41594-021-00562-0
供稿:生物系
通讯员:付文卿
编辑:程雯璟
主图设计:丘妍




