
近日,南方科技大学生命科学学院生物系副教授饶枫课题组在Nature Communications杂志发表了题为“IP6-assisted CSN-COP1 competition regulates a CRL4-ETV5 proteolytic checkpoint to safeguard glucose-induced insulin secretion”的研究论文,报道了一个基于CRL-CSN复合物动态感知葡萄糖来避免胰岛β细胞过度分泌胰岛素的蛋白质降解检查点。这是继2020年报道IP6-CRL-CSN复合物的组装机制和通过调节IP6合成靶向CRL的抑制剂筛选的研究之后,饶枫课题组在CRL E3泛素连接酶领域的最新研究成果。
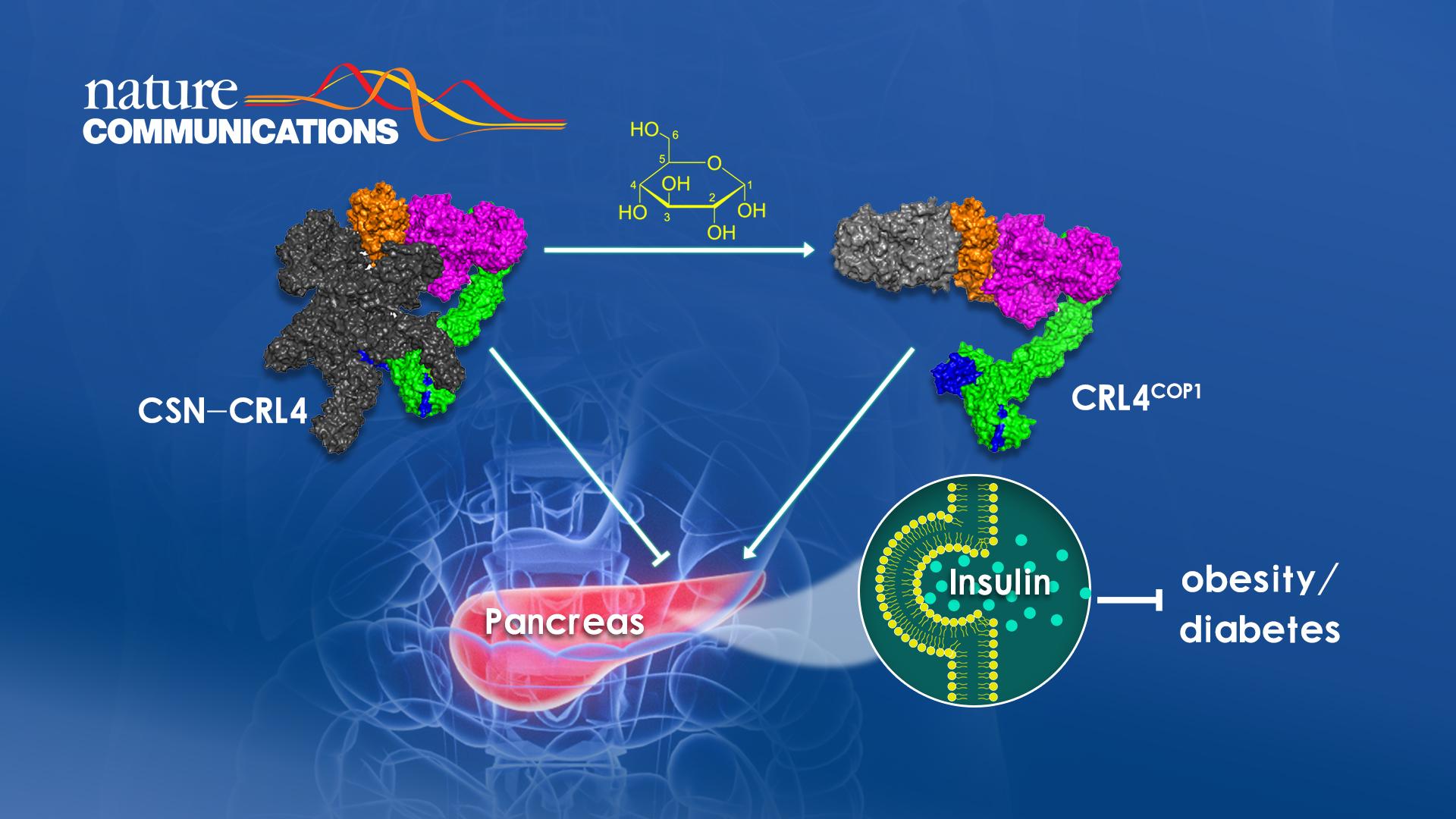
糖尿病发生与胰岛素分泌紊乱密切相关。分泌不足会直接导致糖尿病,而过高会导致高胰岛素血症(Hyperinsulinemia),并最终引发胰岛素抵抗和糖尿病。因此,维持胰岛素的正常分泌对糖尿病的预防和治疗具有重要意义。体内胰岛素分泌受到葡萄糖浓度的精细调控。血糖升高刺激胰岛β细胞分泌胰岛素的短期过程主要是通过能量升高带来的膜去极化使得钙离子内流,进而刺激胰岛素囊泡释放。然而,β细胞是否感知葡萄糖进而通过调节基因表达和蛋白质稳定性来协调胰岛素分泌稳态尚不清楚。Cullin RING Ligase (CRL)是作用于蛋白泛素化降解的一类最重要的E3泛素连接酶。
CRL降解底物时需要被拟素化修饰(Neddylation)激活,在底物降解之后去拟素化酶COP9 Signalosome(CSN)紧密结合并灭活CRL。团队先前发现代谢小分子六磷酸肌醇(IP6)是促进CSN-CRL复合物组装的分子间“胶水”,并解析了IP6-CSN-CRL三元复合体的组装机制和结构基础。但是,对于IP6参与的CRL-CSN复合物组装和解离的生理意义,以及是否受到胞外信号的调控却不清楚。
在该研究中,研究人员通过表征IP6结合缺失而导致CSN功能受损的CSN2-K70E突变体小鼠,发现纯和突变会导致小鼠胚胎致死,而杂合突变体小鼠具有高胰岛素血症和肥胖表型。机制研究发现,在解除CSN的抑制功能后,β细胞内CRL4的拟素化增加,CRL4COP1 E3酶活化,而转录因子ETV5的降解增强。ETV5通过调控Ins1基因和囊泡释放相关因子Sytl3和Exoc6的转录来抑制胰岛素分泌。因此,CSN2-K70E杂合突变体小鼠会持续过度分泌胰岛素,诱发高胰岛素血症和肥胖(图1B)。此外,突变小鼠成年后会逐渐发生胰岛素抵抗,或可作为一个研究胰岛素过量分泌诱发胰岛素抵抗的小鼠模型。
重要的是,该机制不仅仅发生在CSN2-K70E杂合突变体小鼠。生理条件下,CSN-CRL复合物的组装也受葡萄糖动态调控。低血糖时,CSN紧密结合并抑制CRL4。血糖升高则会促使CSN-CRL4解离, 组装并活化CRL4COP1从而降解ETV5并促进胰岛素分泌。因此,CRL4COP1是一个感知葡萄糖的E3泛素连接酶,而葡萄糖依赖的CSN-CRL4到CRL4COP1转换的核心机制是CSN与COP1之间的位阻效应(Steric Hindrance)(图1A)。病理模型研究发现高脂喂养的小鼠或Ob/Ob小鼠里的CRL4COP1-ETV5轴同样过度激活。而CRL拟素化抑制剂MLN4924可有效减缓这两种肥胖/糖尿病小鼠模型的疾病发展。该研究首次发现CSN对CRL的抑制受葡萄糖信号动态调控,揭示了葡萄糖刺激依赖的CRL4COP1-ETV5蛋白降解轴在胰岛素分泌过程中的生理功能,为靶向抑制CRL4COP1-ETV5信号轴而减轻高胰岛素血症诱发的肥胖/糖尿病提供了新思路(图1B)。
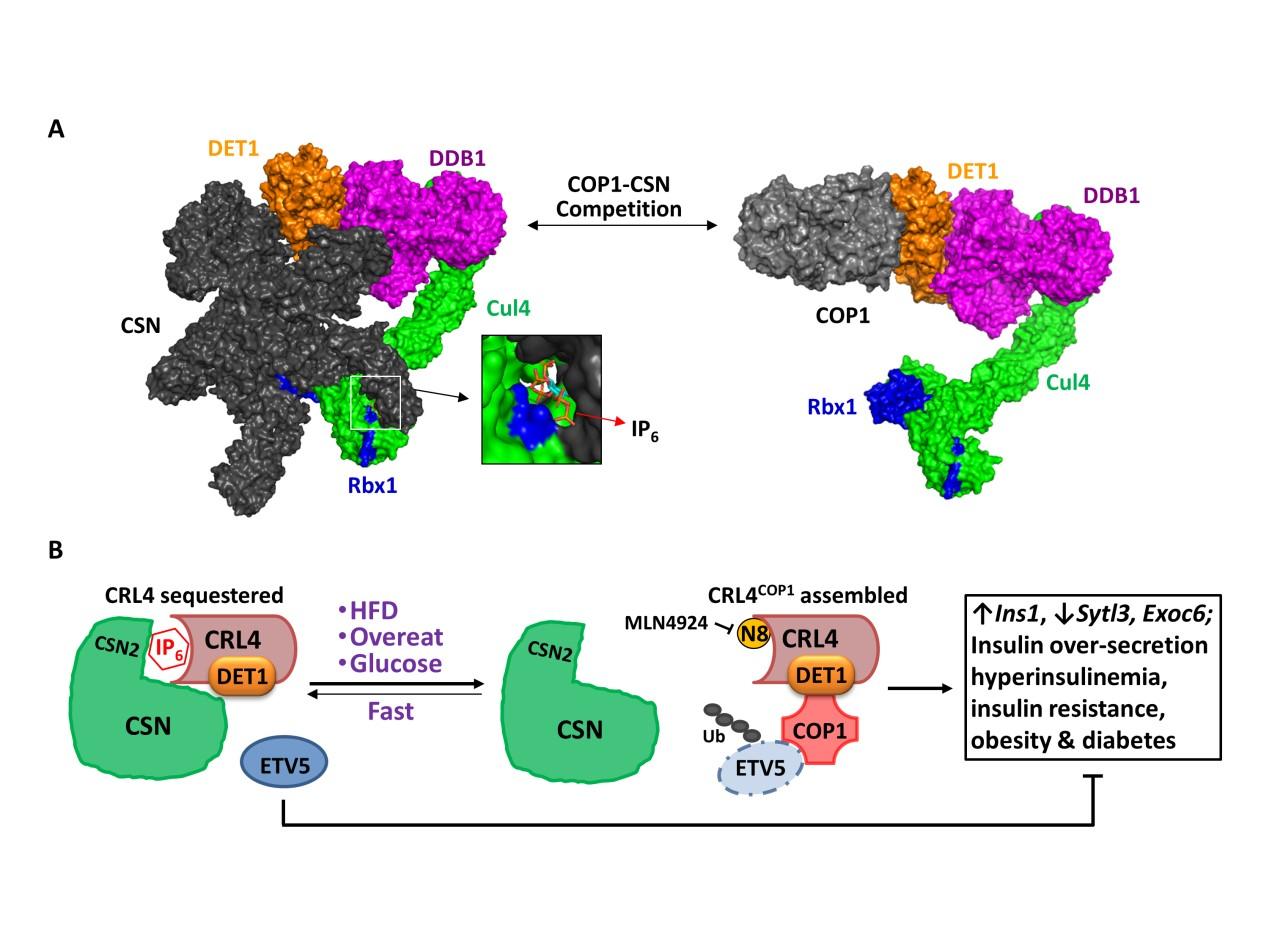
图1. CSN和COP1竞争结合CRL4(A)以及CSN-CRL4和CRL4COP1复合物在葡萄糖感知过程中动态转换以协调胰岛素分泌稳态(B)的示意图。
有趣的是,COP1和CSN(又称为COP9)最初由我校生物系长期杰出访问教授、美国科学院院士邓兴旺团队在植物中被筛选鉴定,证实其参与光(能源)感知并协调植物生长(5,6)。饶枫团队的研究揭示了他们在哺乳动物体内同样协调感知能量来源:葡萄糖。
研究工作主要由饶枫团队在南方科技大学完成,得到了北京生命科学研究所王凤超研究员、新加坡生物成像中心韩卫平教授、香港大学邹国昌教授和南方科技大学第二附属医院姜楠团队的帮助,以及深圳市科创委,国家自然科学基金、国家重点研发计划、广东省自然科学基金和南方科技大学实验动物中心与分析测试中心的资助与支持。饶枫团队的研究学者蔺红,联合培养研究生鄢源、骆怡帆,以及韩卫平实验室的Wing Yan So博士是论文的共同第一作者。饶枫是论文的唯一通讯作者。南科大为论文第一单位。
论文链接:https://www.nature.com/articles/s41467-021-22941-3
供稿:生命科学学院
文字、图片:蔺红、鄢源、骆怡帆
通讯员:付文卿
编辑:劳湘雯




